Мне вообще всегда нравятся статьи Ризетто (того кто и открыл дельту), ясно мыслит старик ))
слегка адаптированный перевод гугл транслейт
так как в статье много вирусологии и проч, то возможно местами получилась чушь
некоторые места переводил как я понял по смыслу, а не дословно ))
Марио Риззетто
Разрабатываемые экспериментальные препараты для лечения гепатита Д
DOI: 10.1080/13543784.2017.1357695
Jul 2017
АННОТАЦИЯ
Введение: Лечение хронического гепатита D по-прежнему зависит от интерферона.
Чтобы повысить эффективность разрабатываются новые терапевтические стратегии,
направленные на доступ вируса гепатита D (HDV) к функциям вируса гепатита B и хозяина, необходимым для его жизненного цикла.
Обсуждаемые направления:
Терапевтические варианты:
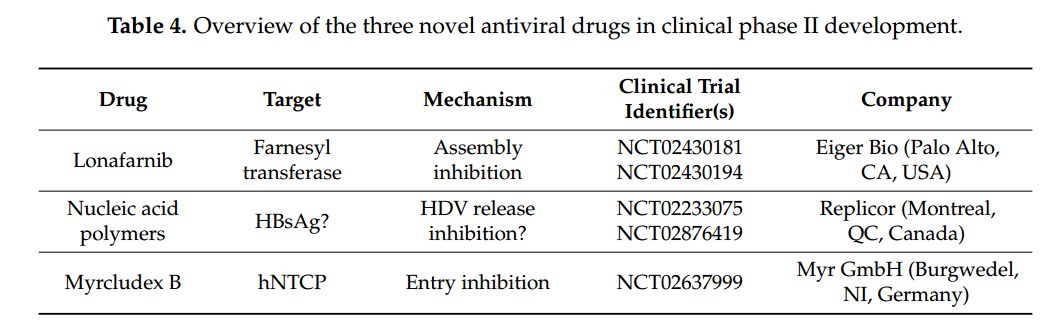
1) Lonafarnib - с целью ингибирования фарнезилирования большого белка HD, при помощи которого осуществляется сборка вирионов,
2) Myrcludex B - с целью блокирование входа HBsAg в клетки путем ингибирования NTCP рецептора гепатоцита для предотвращения распространения HDV на неинфицированные гепатоциты,
3) REP 2139 - с целью уменьшения субвирусных частиц HBsAg, что приводит к уменьшению морфогенеза вирионов.
Экспертное мнение:
Lonafarnib и Myrcludex уменьшают в крови HVD-РНК, не уменьшая в крови HBsAg.
NAP REP-2139 уменьшал как HDV-РНК, так и HBsAg в крови. Ожидается полный отчет.
В сочетании с Peg-Interferon эти новые препараты могут обеспечить дополнительную эффективность.
Основные моменты статьи:
• Благодаря уникальным вирусологическим особенностям вирус Hepatitis D не может быть мишенью обычных противовирусных препаратов.
Предложенные терапевтические стратегии направлены на то, чтобы лишить вирус функций, обеспечивающих его жизненный цикл вирусом гепатита B (HBV) или инфицированным хозяином.
• Lonafarnib, ингибитор фарнезилтрансферазы, предотвращает фарнезилирование большого HD-антигена, необходимого для сборки вириона оболочкой HD рибонуклеопротеина с HBsAg.
Препарат уменьшает титр HDV-РНК в крови, но его эффект не является продолжительным {lasting - прочный, продолжительный} и не уменьшает титр HBsAg.
• Myrcludex B, синтетический myristolated липопептид pre-S1 домена HBsAg, был протестирован на его способность блокировать проникновение (вход) HDV в гепатоциты и контролировать инфекцию,
предотвращая распространение HDV на неинфицированные гепатоциты. Во время терапии он ингибировал репликацию HDV, не уменьшая титр HBsAg, виремия HDV восстанавливалась после терапии.
• REP-2139, полимер нуклеиновой кислоты, активный против HDV путем предполагаемого ингибирования синтеза субвирусных частиц HBsAg, в предварительных отчетах показал, что последовательно уменьшает титр HDV-РНК и HBsAg в крови.
• Lonafarnib, Myrcludex B и REP 2139 лишь частично эффективны при монотерапии, но возможно будут окаывать аддитивный противовирусный эффект в сочетании со стандартной терапией ПегИнтерфероном;
долгосрочные комбинированные терапии и последующие исследования позволят оценить их конечную эффективность при хроническом гепатите D.
1. ВВЕДЕНИЕ
Вирус гепатита D (HDV) был обнаружен в конце 1970-х годов и характеризуется как патогенный микроорганизм печени, зависящий от сопутствующей инфекции вирусом гепатита B (HBV), чтобы вызвать болезнь (1). Исследования 1980-х и 1990-х годов показали, что HDV уникален с точки зрения человеческих вирусов: с круговым геномом около 1700 нуклеотидов, это самый маленький вирус в вирусологии человека, реплицируется с помощью механизма скользящего круга, неизвестного в биологии млекопитающих, вирусная РНК включает в себя рибозим с автокаталитическими способностями и транскрибируется полимеразами хозяина - РНК, обманутыми, чтобы принять шаблон вирусной РНК, как если бы это была Клеточная ДНК (2).
Клинические исследования в 1980-х годах подтвердили, что гепатит D является наиболее тяжелой формой вирусных заболеваний печени (3). Клиническая реакция требовала усилий по лечению заболевания с помощью эмпирических стратегий, которые можно было бы использовать в то время. Использовали сурамин, ацикловир, рибавирин, титановый октапептид TH gamma-2, но безрезультатно (4,5).
Вслед за результатами интерферона (ИФН) при хроническом HBV, в середине 1980-х годов ИФН прошли терапевтические испытания при хроническом гепатите D (ХГД) (6); эффективность была ограничена, но достаточна для лицензирования цитокинов для лечения этого заболевания в конце 1980-х годов.
Терапевтический прогресс не пошел дальше и в этом состоянии застоя IFN остается единственным доступным лечением.
Фармацевтические компании не были заинтересованы в разработке новых методов лечения, считая, что контроль за HBV при помощи вакцинопрофилактики в конечном итоге приведет к искоренению HDV в развитом мире и к отсутствию экономического интереса к заболеванию, преобладающему в неблагополучных регионах мира с плохими финансовыми ресурсами. Тем не менее, во всем мире улучшились диагностические средства и медицинские ресурсы в последние годы, повысилось внимание к гепатиту D как к постоянной и важной глобальной проблеме здравоохранения; повышение осведомленности и глубокое знание биологии HDV, приобретенной в последние десятилетия, теперь стимулирует отрасль исследовать специфические терапевтические стратегии.
В этом обзоре обобщается текущая перспектива; следует отметить, что фармакология HDV все еще очень молода, и соответствующая клиническая литература ограничена, и на момент написания этой статьи были написаны только две полные статьи и несколько тезисов.
2. ОПЫТ ИФН
Стандартные (короткие) IFN альфа-2а и альфа-2b (ИФН) получали в дозах от 3 до 9 миллионов единиц (МлнЕд) в течение 6-12 месяцев. Эффективность оценивалась с точки зрения достижения устойчивого вирусного ответа (SVR), определяемый как нормальный ALT и отрицательный результат РНК HDV в крови, сохраняющийся через 6 месяцев после завершения терапии (7). Короткие курсы (<6 месяцев) и более низкие дозы IFN были менее эффективны, чем более длительные курсы и более высокие дозы; пациенты, получавшие 9 МлнЕд три раза в неделю или 5 МлнЕд ежедневно, ответили лучше, чем те, которые были назначены 3-5 МлнЕд три раза в неделю (6).
Кокрановский обзор стандартных методов ИФН (Abbas Z,Khan MA,Salih M,Jafri W. Interferon alpha for chronic hepatitis D .Cochrane Database of Systematic Reviews 2011 ,issue 12,Art.n° CDC006002 ) пришел к выводу, что только около 18% пациентов достигли устойчивого вирусного ответа; к концу терапии АЛТ были нормальным у 35% пациентов, но через 6 месяцев после терапии продолжало
оставаться нормальными уже только у 12% . Только несколько пациентов, которые очистили HBsAg во время или после терапии получали устойчивый ответ HDV.
Пегелированные ПЭГ-ИФН незначительно повышали эффективность, но в целом менее 30% пациентов достигали УВО; в трех наблюдениях за ПВТ с Peg-IFN альфа-2а или альфа-2b УВО был получен в 17% -43% (9). В самом крупном исследовании HIDIT-1, совокупный показатель УВО составлял 28%, используя Peg IFN либо в монотерапии, либо в комбинации с адефовиром (10). Рецидивы были частыми после терапии;
в исследовании HIDIT-1 у 8 из 16 пациентов, у которых была отрицательная РНК HDV через 6 месяцев после терапии, анализ на РНК HDV снова был положительным по крайней мере один раз во время дальнейшего долгосрочного наблюдения в течение последующих 4 лет (11).
{от себя уже добавлю - по ссылке ниже речь идет о 9 из 16
https://www.ncbi.nlm.nih.gov/pubmed/24585488
причем 7 из этих 16 пациентов были РНК HDV-положительными в самом последнем посещении}
3. ТЕРАПЕВТИЧЕСКИЕ ПЕРСПЕКТИВЫ
Хотя двойная инфекция HBV / HDV может казаться легкой для лечения, поскольку можно использовать различные терапевтические стратегии, нацеленные отдельно как на HBV или HDV, так и на оба вируса, уникальные характеристики HDV и его специфическое взаимодействие с HBV наоборот делают ХГД наиболее сложным для лечения среди вирусных заболеваний печени.
3.1 Цель HBV
Нацеленность только на HBV с помощью противовирусных препаратов в попытке отменить его биологическую помощь HDV неэффективна.
HDV требует от вируса партнера HBsAg, необходимого для покрытия его вириона, но не зависит от зрелого HBV; до тех пор, пока HBsAg продолжает экспрессироваться ядерной ccc-HBV ДНК или интегрированной с хозяином ДНК HBV, HDV может размножаться независимо от уровня циркулирующей ДНК HBV. Ламивудин, адефовир, энтекавир не имели никакого преимущества; они ингибируют синтез ДНК HBV, но не мешают транскрипции HBsAg из РНК-матрицы HBV (12).
3.2 Цель HDV
Прогресс в понимании биологических механизмов HDV вызвал надежду на то, что в ближайшее время будут разработаны новые методы лечения; но к сожалению, вместо того, чтобы предлагать подсказки для терапевтических разработок, знание молекулярной вирусологии HDV объясняет, почему ХГД трудно излечить (2). Геном слишком мал для кодирования сложных белковых функций, необходимых для самостоятельной репликации; без собственных механизмов создания белков, HDV полностью полагается на репликативный механизм гепатоцита. Он реплицируется клеточными ДНК-зависимыми РНК-полимеразами, перенаправленными для дублирования вирусной РНК (13), и это не может быть целью обычных противовирусных препаратов, направленных против вирусных полимераз и протеаз.
Терапевтическая цель сместилась с механизма репликации на внешнюю помощь, предоставляемую жизненному циклу HDV HBsAg или хозяином. В настоящее время исследуемыми мишенями являются процессы, включающие HBsAg-слой вириона, позволяющий проникать в гепатоциты, и морфогенез вирионов в клетках (14), и ферментативные процессы, катализируемые клеточными ферментами хозяина, которые модифицируют две изоформы антигена HD (HD Ag) (15), посттрансляционные модификации двух изоформ, включая ацетилирование, метилирование, фосфорилирование, фарнезилирование, сумоилирование, изменение биологических функций белка HD, обеспечивающее молекулярные переключатели, которые направляют процесс созревания HDV (16).
3.2.1 Ингибирование сборки / высвобождения HD вириона
Критически важным для сборки вириона HD является пренилирование l-HDAg (17). Преренилирование представляет собой модификацию, посредством которой пренил-липиды ковалентно добавляются в белки, чтобы сделать их более липофильными и способствовать взаимодействию белок-белок. Пренилирование l-HDAg приводит к связыванию этого антигена с HBsAg, чтобы собрать вирион.
Пренильная группа, взаимодействующая с l-HD Ag, представляет собой фарнезил. Клеточная фарнезилтрансфераза способствует ковалентному связыванию фарнезила с цистеином в карбоксильном конце l-HDAg.
Потребность в фарнезилировании привела к гипотезе о том, что нарушение этой посттрансляционной модификации может препятствовать сбору вирионов и нарушать выделение HDV в кровь (18). Ингибиторы фарнезилтрансферазы, отменяющие перенос фарнезила в l-HDAg, успешно использовали in vitro и in vivo; Bordier и др. показали в первичных клеточных культурах гепатоцитов, что пренилирование антигена ингибировалось ингибитором BZA-5B (19) и что ингибиторы FTI-277 и FTI-2153 были эффективны при очистке виремии HD в мышиной модели HDV-инфекции (20) .
Lonafarnib (LNF, Sarazar) трициклический производный карбоксамида, первоначально испытанный как противоопухолевый агент (21), был оценен в клиническом исследовании.
Кох и др. (22) рандомизировали пациентов с ХГД (с показателем фиброза 3 по шкале Исхака, все HBeAg-негативные с пограничным HBV ДНК в крови и медианным значением РНК HDV 9,27*10^5 МЕ/мл) в две группы пациентов, получавших лечение в течение 28 дней,
одна из которых получал LNF 200 мг в день, а другая 400 мг в день, против контроля у двух пациентов в каждой группе, получавших плацебо. Два пациента, которые получали плацебо в группе с более низкой дозой, затем получили открытое лечение LNF в более высокой дозе 400 мг.
К концу терапии РНК HDV снижалась на средний -0,73 log10 МЕ/мл в группе с более низкой дозой и на -1,54 log10 МЕ/мл в группе с более высокой дозой; снижение было значительно отличным от группы с плацебо (-0,12 log10 МЕ/мл) (рисунок 1).

Однако сывороточные HBsAg и аминотрансферазы не изменялись и РНК HDV вернулся к исходному уровню у всех пациентов после прекращения терапии.
Не было доказательств мутаций HDV, связанных с отсутствием ответа на LNF.
Терапия была плохо переносимой; Lonafarnib инактивирует фарнезилирование сигнальных молекул, таких как c-Ras (21), которые влияют на клеточные события и могут вызывать значительные побочные эффекты; наиболее серьезные в исследовании Koh были в группе с дозой 400 мг - желудочно-кишечные симптомы (прерывистая рвота/intermittent vomiting/ у 50%) и потеря веса (в среднем 4 кг).
Поскольку Lonafarnib метаболизируется Cytochrome P450-3A4 (23), чтобы уменьшить неблагоприятные эффекты и повысить эффективность, ингибитор CPY3A4 Ritonavir был добавлен для достижения более высокого уровня воздействия препарата
при одновременном эффекте доставки меньшего количества препарата в желудочно-кишечный тракт.
(Это я так понял по смыслу из др.статьи, в оригинале - "has been added to achieve greater drug exposure with lower drug delivery of post absorbed drug")
Исследования под аббревиатурой LOWR HDV (LOnafarnib With Ritonavir для HDV) продолжаются, представлены промежуточные результаты.
В исследовании LOWR HDV-2 (24) Yurdaydin и др. 3 пациента в течение 8 недель получали LNF в дозе 100 мг дважды в день вместе с ритонавиром 100 мг в день.
По сравнению с дозой 100 мг дважды в день и дозой 300 мг дважды в день без ритонавира, LNF плюс ритонавир дали лучший антивирусный ответ, что привело к снижению циркулирующей РНК HDV на -3,2 log10 МЕ/мл после 8 недель терапии; уровни LFN в крови пациентов, получавших ритонавир, были в 4-5 раз выше по сравнению с LNF без ритонавира.
Неблагоприятные последствия для двойной схемы были аналогичны монотерапии, но в меньшей степени.
В LOWR HDV-4 (25), Wedemeyeret оценивали эффективность и переносимость LNF в течение терапии продолжительностью 24 недели.
Пятнадцать пациентов начали терапию с 50 мг LNF и ритонавир 100 мг в день, с увеличением дозы LNF до 100 мг дважды в день.
Прием ритонавира сохранялся на уровне 100 мг независимо от дозы LNF.
Среднее снижение по сравнению с исходным уровнем HDV-РНК составило -0,98 log10 ME/мл на 24 неделе, а у 58% пациентов снижение было более -1,5 log10 ME/мл.
У большинства пациентов была диарея; диарея 3 степени и астения были у трех пациентов.
Со снижением РНК HDV был связан скачок ДНК HBV у пациентов, которые не получали противовирусную терапию против HBV, что указывает на подавляющее действие HDV на репликацию HBV. Не было зафиксировано мутаций HDV.
Снижение HDV не продолжилось после терапии, и после лечения виремия восстановилась; сыворочная HBsAg не изменилась.
3.2.2 Ингибирование входа HBsAg / HDV в гепатоциты
Открытие того, что натрий-таурохолатный котранспортный полипептид (NTCP) является рецептором HBsAg, позволяющий вхождению HDV в гепатоциты (26), привело к исследованию лекарств, ингибирующих функции NTPC в качестве потенциальных методов лечения ХГД.
Используя выражающую NTCP клеточную линию Huh7, Blanchet и др. показали, что Irbesartan, Ezetimibe и Ritonavir могут ингибировать связывание HBsAg с рецептором (27). Связывание также ингибируется циклоспорином (28) и производными циклоспорина SCY446 и SCY45O (29); последние не обладают иммунодепрессивной функцией и не нарушают NTCP-зависимое поглощение желчных кислот.
Эффективность этих препаратов в качестве терапии HDV еще не оценивалась.
Более конкретно, восприимчивость печени человека к HBV зависит от присоединения большого белка HBsAg к гепатоцитам через протеогликаны гепарансульфата с последующим связыванием с NTCP через домен pre-S1 HBsAg (30).
Синтетические липопептиды, которые имитируют сайт связывания рецептора в pre-S1 домене, могут блокировать HBV и HDV, а ацилированные pre-S пептиды из большого белка HBsAg оказались мощными ингибиторами поступления HBV в гепатоциты (31).
В настоящее время образцом блокирующих препаратов, по которым в настоящее время идут клинические исследованиями, является Myrcludex B (MyrB), миристолированный синтетический N-ацилированный пептид preS1 домена HBV, который может прикрепляться к NCTP.
В исследовании, посвященном безопасности, Blank и др. (32) определили, что концентрация MyrB, которая блокирует вход HBV и HDV, в 100 раз ниже, чем ингибирование переноса желчных кислот. Возрастающие дозы MyrB (до 20 мг) вводились здоровым добровольцам.
Препарат хорошо переносился без токсичности, ограничивающей дозу; умеренные и переходные возвышения амилазы и липазы наблюдались у семи пациентов, но проходили без клинических осложнений и разрешались спонтанно.
В экспериментальном клиническом исследовании Богомолов и др. (33) в течение 24 недель предварительно оценивали влияние MyrB на ХГД, чтобы обеспечить доказательство концепции, что ингибирование новой инфекцией еще неинфицированных клеток печени может снизить популяцию HDV-положительных клеток и позволить гепатоцитам, не содержащим HDV, регенерировать, что в конечном итоге приведет к уничтожению вируса соответственно, первичной конечной точкой исследования был ответ HBsAg, определяемый как снижение HBsAg в сыворотке по меньшей мере на 0,5 log МЕ/мл. До сих пор завершенное исследование было представлено только в абстрактной форме (34).
MyrB давали в дозе 2 мг ежедневно подкожно. Несколько пациентов получали MyrB в монотерапии в течение 24 недель, 7 пациентов получали его вместе с Peg-IFN в течение 24 недель. 24-недельные результаты в двух когортах MyrB сравнивали с результатами у 7 пациентов, получавших монотерапию Peg-IFN в течение 24 недель.
Пациентам с монотерапией MyrB затем продолжили лчение только Peg-IFN в течение 48 недель, остальные две группы продолжили лечение только с помощью Peg-IFN в течение 24 недель, так что в конечном итоге все три когорты получили по 48 недель лечения Peg-IFN.
После 24 недель терапии HDV-РНК последовательно снижалось в каждой группе; в группе комбинированной терапии HDV РНК стала отрицательной у пяти из семи пациентов (Рисунок 2A - в скаченной статье я не нашел) и АЛТ, нормализовалась у пациентов, у которых MyrB был монотерапией. Однако сывороточный HBsAg оставался неизменным в обеих группах с MyrB (рисунок 2B).

РНК HDV возвращалась к дотерапийному уровню во время стадии терапии с PEG-IFN без MyrB, а HBsAg уменьшался только к концу исследования (34); последний уменьшился более чем на 1 log10 у 4 из 7 пациентов, в группе с монотерапией MyrB, снижение наблюдалось также у 2 из 6 пациентов, получавших только Peg-IFN.
Лечение хорошо переносилось; оно индуцировало pre-S специфические антитела и клинически незначительное билекислотное увеличение (bileacid elevations) .
3.2.3 Ингибирование высвобождения HBsAG / HDV из гепатоцитов
Полимеры нуклеиновой кислоты (NAP) представляют собой отрицательно заряженные молекулы, состоящие из одноцепочечных фосфоротиотированных олигонуклеотидов; они обладают противовирусной активностью, основанной на амфипатии, вызванной фосфоротиоацией (35).
NAP мешают первоначальной неспецифической адсорбции вирусов на поверхности клетки.
Антивирусный эффект не зависит от последовательности, но зависит от размера, требуя по меньшей мере 20 нуклеотидов для значительной противовирусной активности; токсичность может быть проблемой, требующей внимания к дозировке и продолжительности лечения.
Исследования уток, зараженных вирусом гепатита утки (DHBV), показали, что NAP могут блокировать вход DHBV в клетки (36).
Vaillant и др. (35) предположили, что NAPS может препятствовать присоединению HBV / HDV к гепарансульфатным протеогликанам также у людей и постулируется, что они могут нарушить морфогенез вирионов через интерференцию с синтезом субвирусных частиц HBsAg.
Исходя из этого, они начали клинический курс лечения ХГД с использованием комплекса Кальций Хелат NAP REP-2139, сначала в монотерапии, а затем вместе с Peg-IFN.
В исследование было включено 12 отрицательных пациентов с HBeAg, которым 500 мг REP 2139-Ca вводили один раз в неделю в течение 15 недель с последующим недельным совместным введением 250 мг REP-2139 и 180 мкг Peg-IFN в течении еще 15 недель; затем терапия Peg-IFN продолжалась еще 33 недели, после чего пациенты наблюдались в течение 24 недель.
Исследование продолжается и пока представлены промежуточные результаты.
Последние из них (37) показали значительное снижение HDV-РНК у всех 12 пациентов во время монотерапии REP 2139, этот вирусный маркер стал отрицательным у 6 пациентов. Число пациентов, которые избавились от РНК HDV, еще больше увеличилось во время стадий двойной REP2139/Peg-IFN и монотерапии Peg-IFN; однако, произошел рецидив виремия у 4 пациентов после терапии. Параллельно с снижением РНК HDV уровень HBsAg в крови последовательно снижался; 5 пациентов остались HBsAg-отрицательными на протяжении всего наблюдения, у ответчиков HBsAg появились значительные титры анти-HB и поддерживались на протяжении всего наблюдения.
Следует отметить, что клиренс сывороточного HBsAg сопровождался локальным повышением АЛТ.
4. ЭКСПЕРТНОЕ МНЕНИЕ
Нынешний терапевтический подход к ХГД направлен на то, чтобы лишить HDV доступа к функциям HBV или хозяина, которые имеют решающее значение для вирусного цикла. Потенциальные точки вмешательства - это блокирование входа HDV в гепатоциты и вмешательство в ферменты хозяина, которые вызывают ключевые посттрансляционные модификации HDAg. Эти подходы обеспечивают высокий барьер к резистентности, поскольку цель терапии не связана с генетикой HDV; однако, вмешиваясь в работу клеточных мишений, ингибиторы ферментов человека могут вызывать серьезные побочные эффекты, а терапевтическое дозирование должно быть значительно ниже, чем индуцирующая токсичность в клетках.
Ингибитор фарнезилирования LONAFARNIB может снизить HDV в зависимой от дозы, таким образом и создавая новую стратегию нацеливания на вирусную инфекцию. Однако лечение сроком до 24 недель достигало только снижения HDV-РНК; необходимы длительное лечение для снижения уровня HDV-РНК в сыворотке крови до такой степени, чтобы она больше не обнаруживалась. При длительной терапии серьезные побочные эффекты, вызываемые препаратом, являются проблемой; они были смягчены комбинацией с ритонавиром, но симптомы желудочно-кишечного тракта, вероятно, останутся проблемой при длительной терапии, и ритонавир сам по себе может вызывать побочные эффекты. На прример LNF можно предположить, что другие посттрансляционные модификации белка HD могут быть нарушены; процессы, приводящие к фосфорилированию HD Ag, метилированию, ацетилированию, сумоилированию /the processes leading to HD Ag phosphorylation, metylation, acetylation, sumoylation/, также могут быть нацелены на специфический фермент-хозяин при условии исключения клеточной токсичности.
Монотерапия в течение шести месяцев с MYRCLUDEX B, образце препарата, вмешающего в NTCP для предотвращения проникновения HBsAg, сопровождалась значительным снижением РНК HDV и ее клиренсу у двоих; с точки зрения клинической значимости, лечение привело к нормализации аланин-аминотрансферазы у шести пациентов. Однако MyrB не уменьшал титр сывороточного HBsAg; расхождение является загадочным, так как ожидалось, что HBsAg должна уменьшаться как и сывороточная РНК HDV. Первоначальная эффективность MyrB не оправдала ожиданий после отмены препарата, РНК HDV в крови вернулся у всех пациентов.
Полимер нуклеиновой кислоты REP 2139 быстро и значительно уменьшал как РНК HDV, так и HBsAg в крови. Для доказательства теоретической концепции в настоящее время проходит клиническое исследование, и будет интересно узнать, сохранятся ли превосходные ранние результаты терапии после ее окончания терапии; с нетерпением ожидаем полную информация об исследовании в подробной официальной бумаге, а не в виде предварительных тезисов.
Таким образом, три новых исследуемых препарата проявляют лишь частичную эффективность в монотерапии. Вместо препаратов для монотерапии они, как представляется, обеспечивают терапевтическое дополнение для повышения эффективности стандартной терапии Пег-ИФН. Дальнейшие исследования, проводимые с этими препаратами, были разработаны в сочетании с цитокином; предварительные результаты показывают, что комбинация LNF с PegIFN заметно увеличивает снижение РНК HDV сыворотки над монотерапией LNF (38).
Поскольку LNF, MyrB и Rep 2139 направлены против разных этапов синтеза HDV, теоретически можно было бы задействовать не только один, но два или три из них в сочетании с Peg IFN; однако привыкание (tolerance) и токсичность, вероятно, будут проблемой.
Важно признать, что при оценке эффективности лечения клиренс РНК HDV может иметь ограниченную клиническую значимость в отсутствие воздействия на HBsAg. Принятая конечная точка терапии как УВО была получена из опыта гепатита С, то есть формально означает отрицательный результат в тесте на наличие РНК HDV в крови, полученный через шесть месяцев после терапии.
Инфекциозность HDV на фоне HBsAg-положительного состояния может быть очень высокой, намного большей, чем чувствительность современных анализов для HDV-РНК в крови (10 вирусных геномов / мл), и в эксперименте HDV передавался шимпанзе носителям HBsAg
при разведении инфекционной сыворотки 1 к 10^(11) для шимпанзе носителей HBsAg (39). Поэтому пациенты с ХГД, которые достигают УВО для HDV-РНК, но остаются положительными HBsAg, как и происходит в большинстве случаев, все еще могут содержать HDV в неопределяемых количествах, которое, тем не менее, может вызвать повторную инфекцию. Признание того, что при HDV-инфекции УВО для РНК HDV не может предвещать излечение, привело к выводу, что
элиминация HBsAg является единственной надежной серологической конечной точкой терапии (40,41). Если HBsAg сохраняется, требуется новая парадигма, позволяющая прогнозировать, будут ли новые методы лечения в конечном итоге вызывать эрадикацию HDV и лечение гепатита D. Поскольку УВО может быть только частью терапевтической цели при ХГД, длительное клинически беспрецедентное наблюдение после терапии необходимо для подтверждения эрадикации HDV и исключения отсроченных рецидивов гепатита D; мониторинг снижения HBsAg возможно являются лучшим показателем в прогнозировании (42).
Будущие терапевтические вмешательства будут рассматривать нацеливание на вирусный рибозим и область кодирования HD Ag с помощью антисмысловых и глушительных /antisense and silencing/ РНК и небольших ингибирующих молекул. Две РНК, заглушающие ген HDV, кодирующий HDAg, были разработаны и подтверждены с использованием вычислительных методов (43).
/Дальше вообще трудно переводимое/
In vitro studies have shown that antisense oligodeoxynucleotides complementary to the the ribozyme self-cleavage site and antibiotics of the aminoglycoside, peptide and tetracycline classes, interfere with the HDV ribozyme inhibiting the cleavage of the viral RNA (44) ; strong inhibitors are the copper-complexed forms of Amoxicillin, Apramycin and Rystomycin A (45).
Utilizing a Huh-7/HNTCP cell culture system , Buchmann et al ( 46 ) evaluated with a semi-automated method the influence of different drugs on HDV infection and replication.
The ribozyme inhibitors Tubercidin, 2-fluorouridine and tyocamycin induced marked cellular toxixity while IFN alfa-a and beta-1-a had a specific inhibitory effect on HDV infection. Of 160 human kinase inhibitors covering all the human kinome , none caused a significant decrease of HDV infection.
В будущем внимание следует также уделить иммуномодулирующей терапии. HDV может уклониться от иммунной атаки, ингибируя передачу интерферона типа 1, и стимуляция Т-клеточного ответа может привести к элиминации инфицированных гепатоцитов (47).
Обоснование разработки терапевтических вакцин вытекает из экспериментальных данных; клеточные иммунные ответы против HDV вызывались у мышей с помощью ДНК-вакцин, экспрессирующих HD Ag (48), а вакцина HD Ag-p27 защитила 5 из 7 древесных сурков от коинфекции вирусом гепатита сурка с HDV (49). Следует также учитывать укрепление врожденного иммунитета; У гуманизированных мышей коинфекция HDV / HBV индуцировала врожденный ответ сильнее, чем моноинфекция HBV (50).
 Подробнее
Подробнее