Содержание статьи
- Вирус гепатита Д
- Эволюция и эпидемиология
- Клинические особенности
- Основные маркеры гепатита Д
- Особенности болезни и лечение гепатита Д
- Лечение острого гепатита D
- Лечение хронического гепатита D
- Важные моменты, касающиеся лечения ХГД
- Новые лекарства, нацеленные на лечение HDV-инфекции
- Результаты исследования препаратов
- Выводы
Вирус гепатита Д
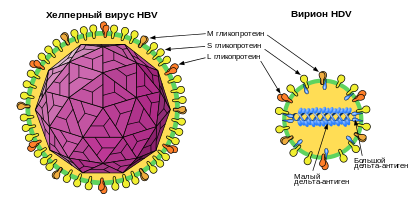
Вирус гепатита Д, (HDV, дельта, или вирус гепатита D) - дефектный инфекционный вирус, вызывающий гепатит D у человека, представляет собой небольшой РНК-содержащий вирус, который изначально был описан у пациентов с более тяжёлым течением хронического гепатита B. Впервые данный вирус обнаружен более 35 лет назад.
Отличительной особенностью данного инфекционного агента является то, что он имеет ряд общих свойств как с вироидами растений, так и с вироид-подобными сателлитными РНК растений, используя оболочечные белки вируса гепатита В (HBsAg) для упаковки своего генома.
Эволюция и эпидемиология
Как правило, носителем заболевания гепатит Д является только человек. Данные исследований говорят об африканском происхождении вируса. HDV характеризуется высокой степенью генетической гетерогенности. Считается, что эволюцию HDV обеспечивают 3 основных механизма: мутации, редактирование и рекомбинация.
Необходимо так же отметить, что скорость мутирования HDV выше, чем у большинства РНК-содержащих вирусов, в связи с этим, предполагается, что HDV циркулирует в пределах одного заражённого организма-хозяина как ряд квазивидов.
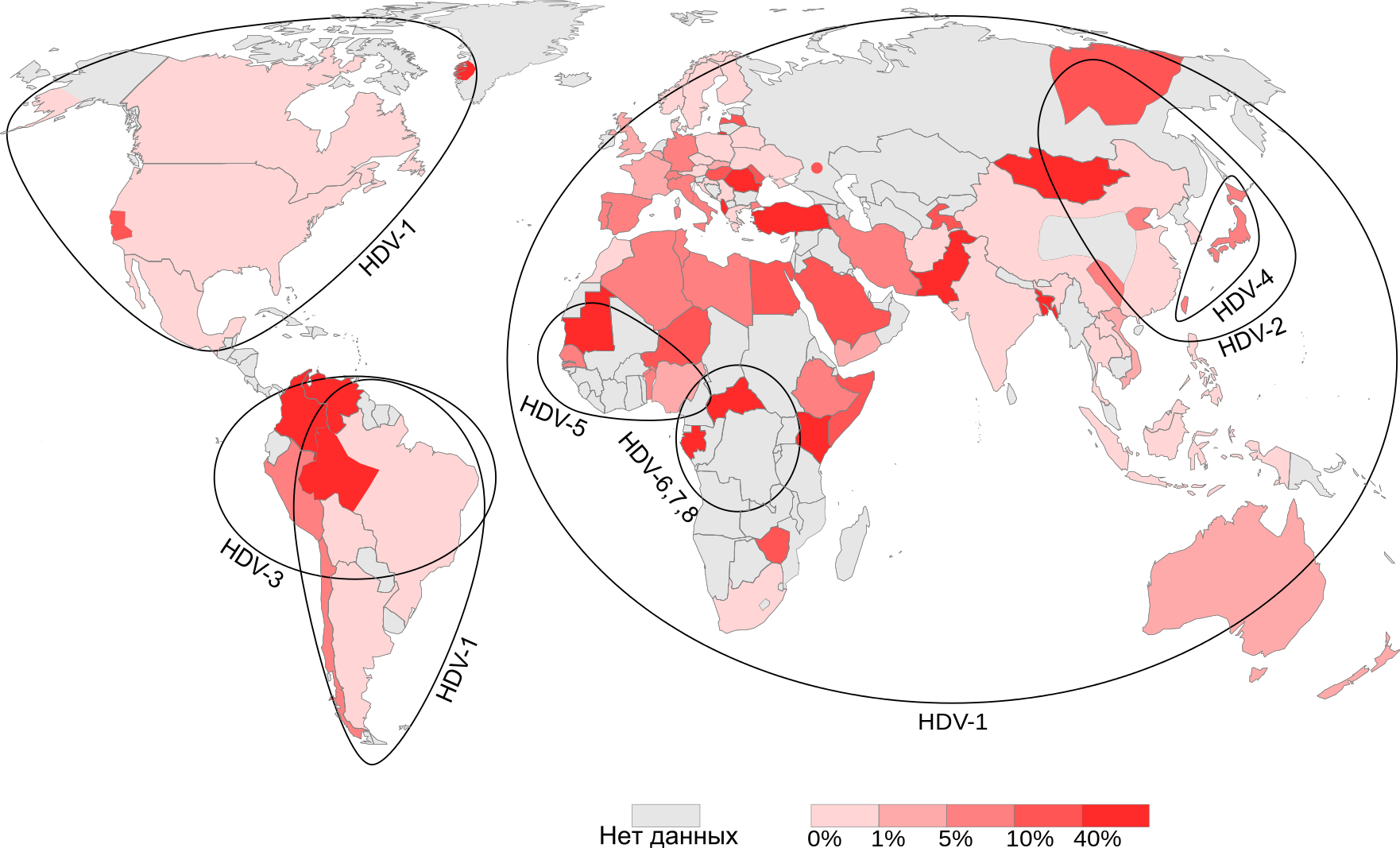
Первоначально было описано 3 генотипа этого вируса (I—III). Генотип I был выделен в Европе, Северной Америке, Африке и некоторых регионах Азии. Генотип II встречается в Японии, на Тайване, а также в Якутии. Генотип III известен исключительно в Южной Америке (Перу, Колумбия и Венесуэла). Сейчас известно, что существует, по меньшей мере, 8 генотипов вируса гепатита дельта (HDV-1 — HDV-8). Все они, за исключением HDV-1, приурочены к строго определённым географическим регионам. HDV-2 (ранее известный как HDV-IIa, найден в Японии, на Тайване и в Якутии; HDV-4 (HDV-IIb) — в Японии и на Тайване; HDV-3 — в районе Амазонки; HDV-5, HDV-6, HDV-7 и HDV-8 — в Африке
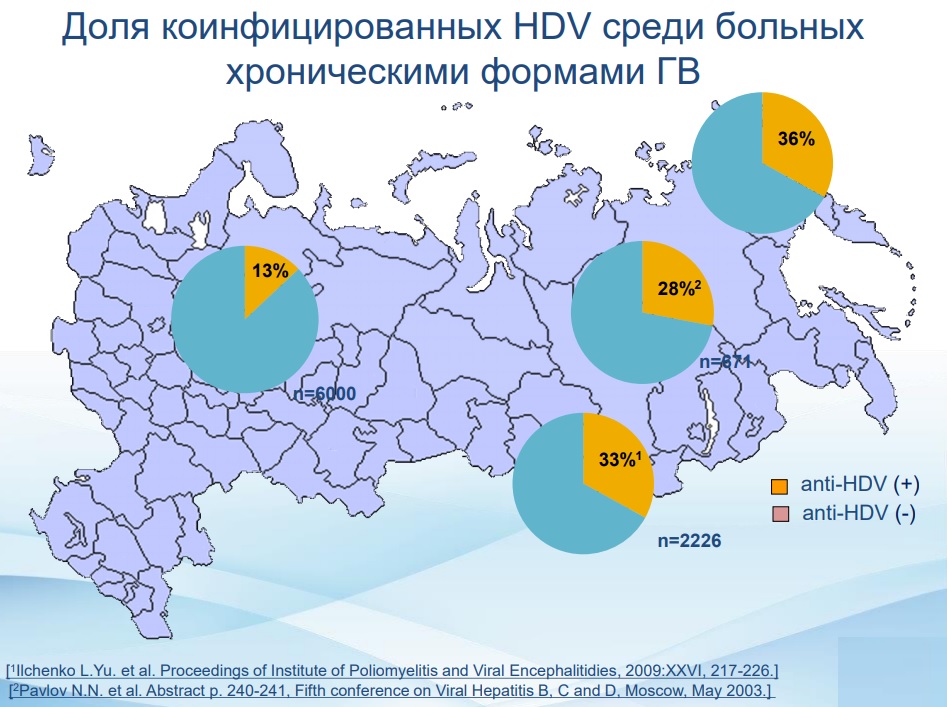
По всему миру вирусом гепатита дельта инфицировано около 20 миллионов человек, что делает его важной проблемой современного здравоохранения
Клинические особенности
Репликация (размножение) вируса гепатита B не приносит вред человеку сама по себе. Повреждение печени происходит из-за ответа иммунной системы организма хозяина на эту инфекцию. Иммунитет убивает инфицированные вирусом клетки печени.То же, вероятно, верно и для вируса гепатита Д. Впрочем, существуют экспериментальные ситуации, когда репликация вируса гепатита дельта приводила к гибели печёночных клеток – гепатоцитов.
Симптомы гепатита D такие же, как при гепатите B, однако степень их выраженности гораздо выше. К отличительным особенностям хронического гепатита D можно отнести его высокую циррозогенность. Кроме того, показана возможность участия вируса гепатита дельта в развитии аутоиммунных заболеваний печени и щитовидной железы.
Течение болезни так же может зависеть от генотипа вируса гепатита Д: инфекция, вызванная вирусом генотипа 1, характеризуется более тяжёлым течением, чем вызванные вирусами генотипов 2 и 4. Кроме того, большой дельта-антиген (L-HDAg) способен вызывать изменения протеома клеток, которые способствуют их злокачественному перерождению; таким образом, гепатит D может лежать в основе гепатоцеллюлярной карциномы.
В некоторых регионах, таких как бассейн Амазонки, очень велик риск развития фульминантного (молниеносного) гепатита дельта.
Основные маркеры гепатита D:
- IgM анти-HDV — антитела класса М к вирусу гепатита Д маркируют репликацию HDV в организме, коррелируют с гистологической активностью и долгосрочным курсом заболевания;
- IgG анти-HDV — антитела класса G к вирусу гепатита свидетельствуют о возможной инфицированности HDV или перенесенной инфекции.
- HDAg антиген вируса HDV — маркер наличия HDV в организме, можно обнаружить только в тканях печени.
- HDV-RNA — РНК вируса HDV маркер наличия и репликации HDV.
Особенности болезни и лечение гепатита Д
Острый дельта-гепатит, в результате ко-инфекции с вирусом гепатита В встречается довольно редко, но в ряде случаев может привести к фульминантному гепатиту, лечение которого не существует. Хронический дельта-гепатит (ХГД) в основном развивается в результате суперинфекции вирусом дельта гепатита (HDV) носителя поверхностного антигена гепатита B (HBsAg). Как и в случае с другими вирусными инфекциями, терапия должна быть адаптирована под доминирующий вирус, которым в подавляющем большинстве случаев является HDV. Тем не менее, смена доминирующего вируса может происходить с течением времени. В редких случаях, вирус гепатита В (HBV) может стать доминирующим, в это время требуется назначение терапии аналогами нуклеоз(т)идами.
Единственным методом контроля и лечения хронического дельта-гепатита является интерферон альфа, который должен вводиться в дозах, используемых для лечения гепатита В в течении, как минимум, 1 года. Вирусологический ответ в течении 24 недель после лечения является наиболее широко используемым суррогатным маркером эффективности лечения, но не представляет собой устойчивый вирусологический ответ (т.н УВО), как в случае с гепатитом С. Поздние рецидивы широко распространены. В качестве простого в использовании серологического теста так же используется анти-HDV-IgM, который, как выяснилось, коррелирует с гистологической воспалительной активностью и клиническим долгосрочным курсом; однако, данный тест не обладает такой чувствительностью и специфичностью, как РНК HDV при оценке реакции на лечение.
В настоящее время не существует основанных на фактических данных правил и рекомендаций для лечения ХГД. Продолжительность лечения должна быть индивидуализирована на основе вирусологического ответа в конце лечения/наблюдения. Эффективное лечение может уменьшить риск возникновения осложнений, связанных с печенью, таких как декомпенсация цирроза, ГЦК и смерть. Пациентам с декомпенсированным циррозом, интерфероны противопоказаны к применению и единственным вариантом для них является трансплантация печени. Поиск альтернативных вариантов лечения является настоятельной необходимостью. В отличие от инфекции HBV и HCV, прямое ингибирование репликации HDV невозможно. HDV реплицируется при помощи механизма двойного катящегося кольца, а также использует клеточную РНК-полимеразу II, со способствующими функциям РНК-полимеразы I и III, все из которых являются полимеразами-хозяина и поэтому не должны подвергаться воздействию со стороны противовирусных агентов.
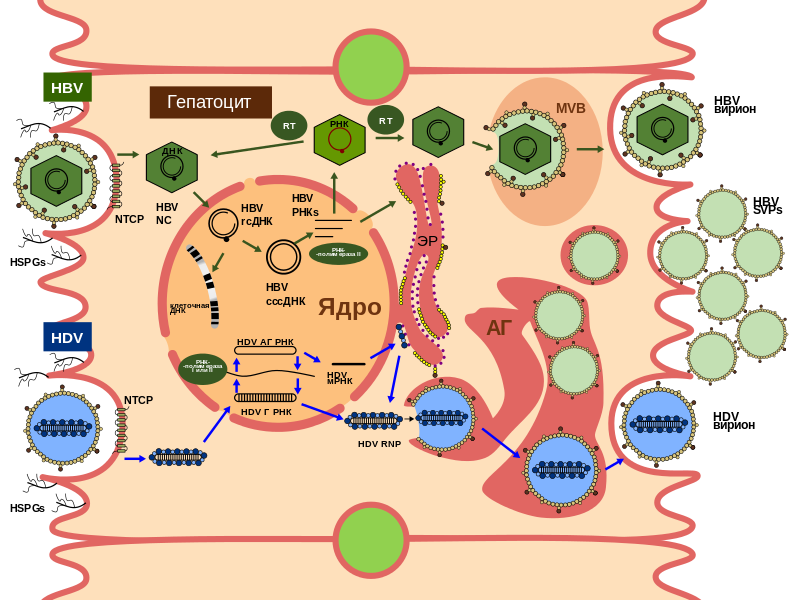
HDV становится менее распространенным патогеном, несмотря на эндемичные регионы, в основном затрагивающие районы мира с низким социально-экономическим статусом. Низкое финансовое обеспечение, к сожалению, является вероятным объяснением отсутствия интереса со стороны крупнейших фармацевтических компаний к разработке лекарств для лечения ХГД, и проблема развития перспективных направлений в настоящее время больше зависит от академических институтов. Тем не менее, новые руководящие принципы лечения, скорее всего, будут приняты, т.к появляются новые стратегии лечения, нацеленные на различные этапы жизненного цикла HDV, такие как ингибиторы входа вирусных частиц в клетку, ингибиторы пренилирования или ингибиторы высвобождения HBsAg.
Лечение острого гепатита D
Острый гепатит Д (ОГД) напоминает типичный самоограниченный гепатит, который клинически и гистологически неотличим от гепатита B или других типов вирусных гепатитов. Это может, однако, привести к двухфазному типу гепатита, возможно, связанному с последовательной экспрессией двух вирусов .
Острый процесс может клинически варьироваться от легкого гепатита до фульминантного, приводящего к смерти больного. В ранних исследованиях, проведенных как в США, так и в Европе, было ясно показано, что коинфекция HBV/HDV чаще приводит к более тяжелому гепатиту по сравнению с пациентами, моноинфицированными HBV. Однако недавнее исследование проведенное в Испании сообщило о развитии молниеносного гепатита, относящегося к HDV, только у двух (1,7%) из 115 пациентов, позволяя предположить, что острый фульминантный гепатит D все-же редко встречается. Это хорошая новость, так как никакой терапии ОГД с доказанной эффективностью не существует.
Лечение хронического гепатита D
Единственной терапией с доказанной эффективностью является лечение интерферонами. На протяжении многих лет различные препараты были использованы в лечении ХГД, но ни один из них не оказался эффективным. Первые исследования с интерферонами были проведены в конце 1980-х годов. Несколько исследований в конце 1980-х и начала 1990-х годов предполагали, что продолжительность лечения, вероятно, не должна быть меньше 1 года, и что интерферон-альфа (IFN-α)-2a или IFN-α-2b следует назначать в дозе 9-10 миллионов единиц три раза в неделю.
Результаты опубликованных исследований:
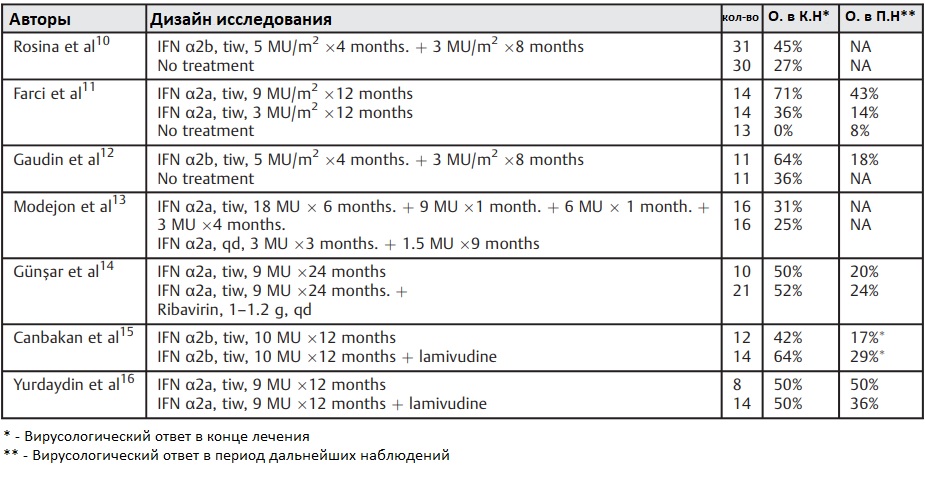
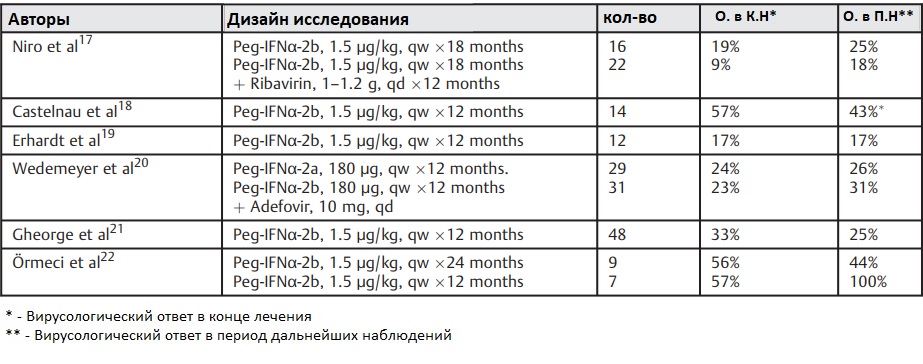
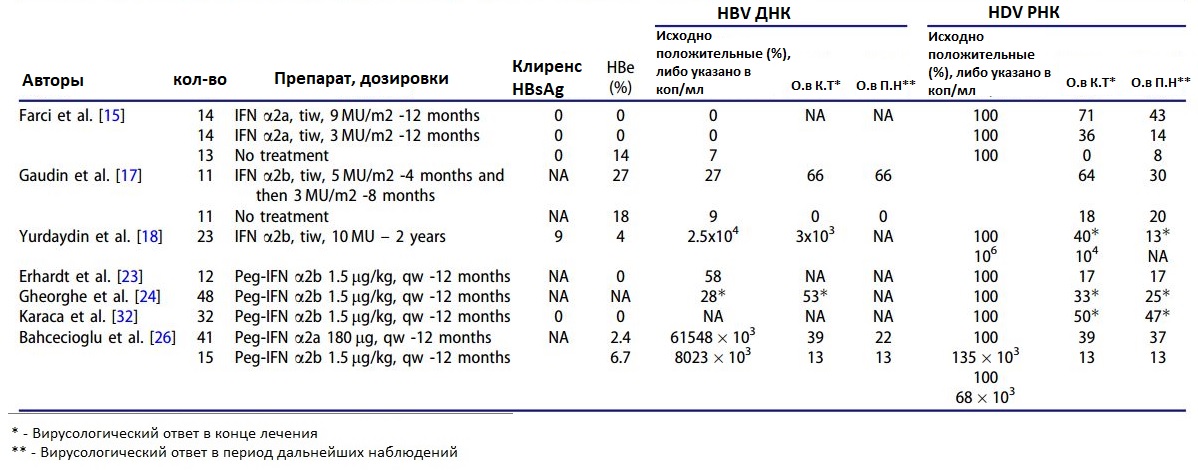
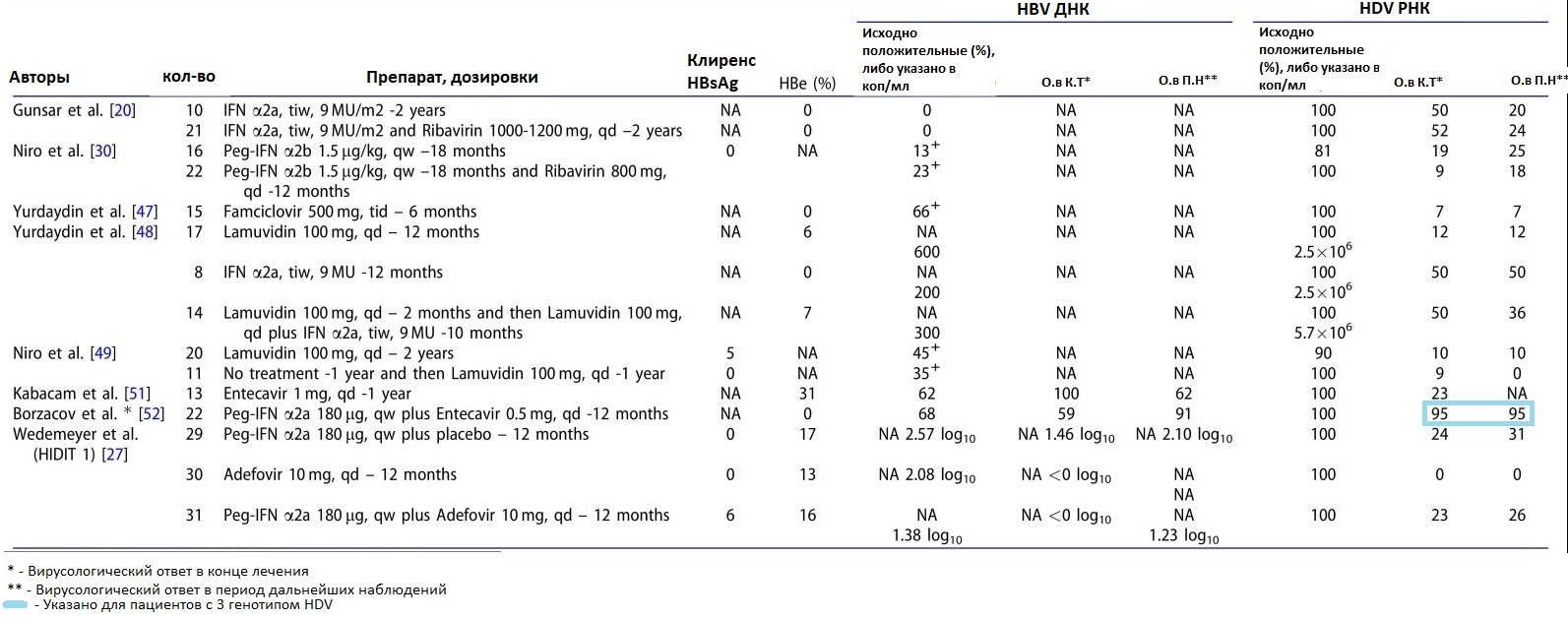
Реакция на лечение оценивается в большинстве публикаций на 24 неделе лечения, и пациенты, у которых наблюдается отрицательная РНК HDV в этот момент времени, считаются вирусологическими ответчиками. Терапия интерфероном в течение 1 года приводит вирусологической реакции у около 25% пациентов, что явно подчеркивает необходимость оптимизации лечения и поиска альтернативных вариантов.
Важные моменты, касающиеся лечения ХГД:
Чтобы оценить эффективность лечения, необходим надежный суррогатный маркер успеха лечения. Лучшим результатом лечения является клиренс (или потеря) HBsAg; однако эта цель очень редко достигается в клинической практике. Суррогатным маркером эффективности лечения является устойчивый вирусологический ответ, то есть снижение и поддержание уровней HDV-РНК на не определяемом уровне . К сожалению, в настоящее время нет стандартизованного анализа для количественного измерения РНК HDV. Отсутствие стандартизации является серьезной проблемой. Даже в референтных лабораториях наблюдались расхождения результатов с теми же образцами сыворотки. В какой-то степени это может объяснить различия в скоростях достижения устойчивых вирусологических ответов, о которых сообщалось в прошлых исследованиях.- Насколько устойчивым и надежным является устойчивый вирусологический ответ? Как было описано выше, в большинстве исследований устойчивым вирусологическим ответом является отсутствие обнаруживаемой РНК вируса в течении 24 недель после терапии, аналогично подходу при хроническом гепатите С. Однако надежность этой конечной точки лечения как показателя долгосрочного сдерживания HDV не была подтверждена. Некоторые пациенты могут стать отрицательными по HDV-РНК даже после терапии интерфероном (Niro et al., 2006 ; Wedemeyer et al., 2011 , 2014) Примечательно, что HDV может оставаться инфекционным при очень низких титрах, что значительно ниже уровня, который можно определить с помощью текущих тестов (порог чувствительности 10 копий / мл ). HDV передавался носителям HBsAg (шимпанзе) при помощи сыворотки, разведенной 11 раз, что является самым высоким инфекционным потенциалом. Поэтому, если HBsAg остается обнаруживаемым, остаточные очень малые количества HDV, скрытые в печени, могут реактивировать инфекцию HDV и повторить повреждение печени.
- При хроническом гепатите С, накопленные данные свидетельствуют о различии в ответе на лечение между пациентами, не получавшими лечение, и пациентами, прошедшими лечение в прошлом. В исследовании, проведенном в Италии, наихудший исход терапии гепатита D был независимым предиктором эффективности последующего лечения (Niro et al., 2006). Тем не менее, в двух крупнейших исследованиях (HIDIT-1 и HIDIT-2) не было выявлено различий в вирусологическом ответе у пациентов, не получавших ранее лечения, и пациентов, получавших лечение (Wedemeyer et al., 2011 , 2014).
Лечение пегилированным интерфероном должно длиться не менее 1 года, хотя оптимальная продолжительность лечения пока неизвестна. В нескольких клинических исследованиях 2 года лечения, по-видимому, не обеспечивали более высокий уровень вирусной реакции по сравнению с 1 годом ( Di Marco et al., 1996 ; Günşar et al., 2005 ; Yurdaydin et al., 2007 ; Örmeci et al. 2011). Тем не менее, это были небольшие клинические исследования, и любое заключение, основанное на этих исследованиях, рискует ввести в заблуждение. Недавно проведенное исследование HIDIT-2, в котором терапия на основе интерферона проводилась в течение 2 лет, по-видимому, не увеличивала вероятность ответа после лечения и была связана с высокими показателями рецидива после прекращения ( Wedemeyer et al., 2014 ). Однако, по мнению экспертов, данные, хотя и ограничены, позволяют предположить, что отдельные пациенты могут нуждаться в длительности лечения более 1 года ( Lau et al. , 1999a ; Kabaçam et al., 2011 ; Heller et al., 2014 ), но продолжительность вероятно, будет определяться на индивидуальной основе. Сообщалось о суммарной продолжительности лечения до 10 или 12 лет (Lau et al. 1999a ; Kabaçam et al. 2011 ). Недавнее исследование показало, что интерферон может задерживать введение HDV в гепатоциты ( Han et al., 2011)). Это говорит о том, что эффективность терапии интерфероном может заключаться в блокировании распространения HDV на другие гепатоциты, а не действуя в качестве прямого противовирусного агента, что еще больше рационализирует необходимость долгосрочного лечения. - Могут ли другие параметры использоваться для оценки эффективности лечения? Количественная оценка HBsAg теоретически может предоставить дополнительную информацию. Это подтверждают данные, которые показывают, что успешное лечение интерфероном связано с уменьшением не только HDV РНК, но и количественных уровней HBsAg ( Manesis et al., 2007 ). Кроме того, наблюдалась корреляция между уровнем сывороточной РНК HDV и уровнями HBsAg, но не с уровнями ДНК HBV ( Zachou et al., 2010)). Однако количественный уровень HBsAg не был независимым предиктором эффективности лечения (O Keskin, H Wedemeyer, A Tüzün, et al., Unpubl.).
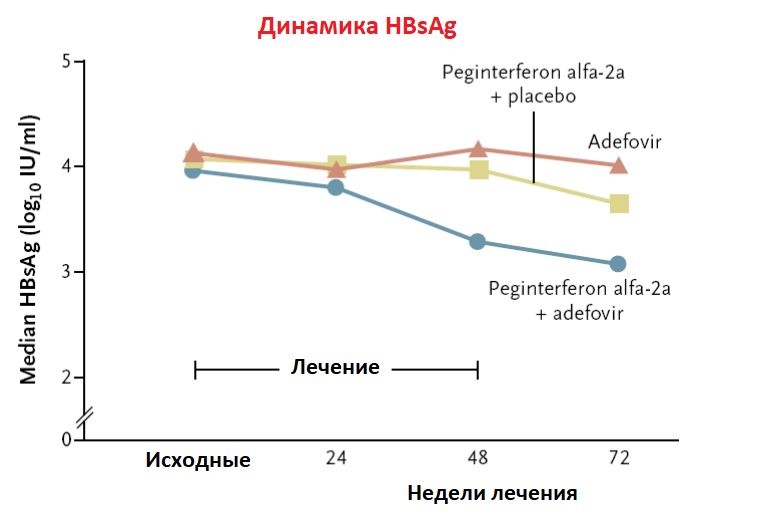
- Комбинированные режимы лечения INF с нуклеоз(т)идными аналогами были изучены в надежде повышения частоты ответов. Тем не менее, эти попытки были разочаровывающими. Никакого увеличения вирусологического ответа не наблюдалось при комбинации INFα с ламивудином. Аналогично, комбинации обычных и Peg-INF с рибавирином, а в последнее время и комбинация адефовира с Peg-IFN не увеличивали вирусологический ответ по сравнению с монотерапией INF или Peg-INF. Однако, комбинированная терапия была более эффективной по сравнению с монотерапией Peg-INF по темпам снижения уровней HBsAg. Более обнадеживающие результаты наблюдались у пациентов с ХГД, коинфицированных вирусом иммунодефицита человека (ВИЧ); значительное снижение РНК HDV наблюдалось у 13 из 16 пациентов при лечении тенофовиром в течении 6 лет. Поскольку нельзя ожидать прямого эффекта тенофовира на продукцию HBsAg, должна потребоваться длительная терапия для того, чтобы этот прием оказал влияние на синтез HBsAg.
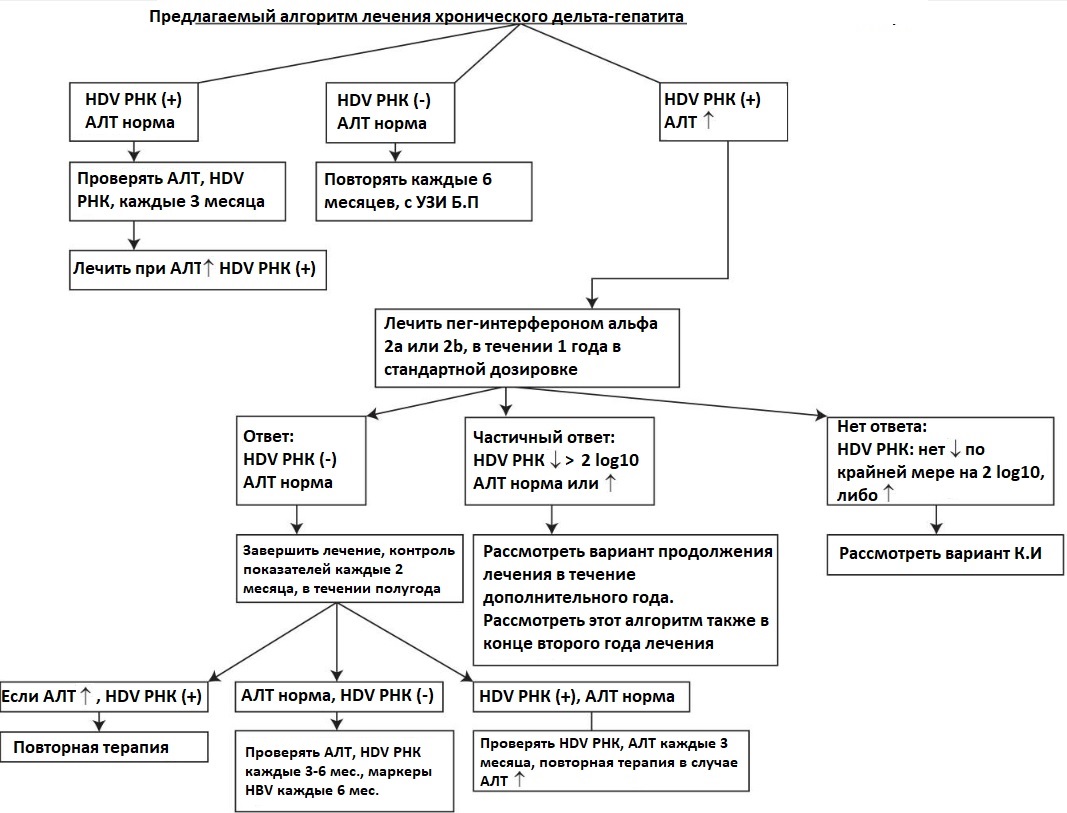
Было предложено несколько алгоритмов лечения ХГД с помощью интерферона, один из них показан ниже:
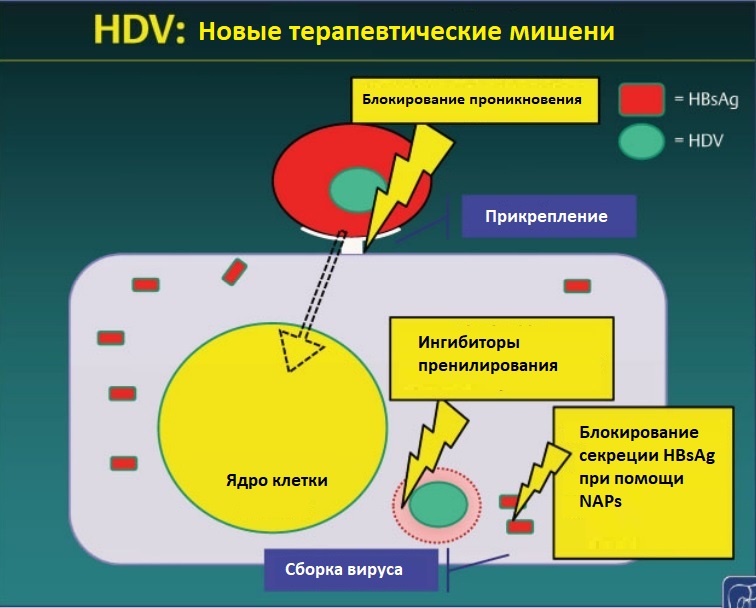
Новые лекарства, нацеленные на лечение HDV-инфекции
Myrcludex B
Признание того, что NTCP является рецептором входа для HBV и HDV в гепатоциты, привело к исследованию in vitro и на животных моделях нескольких препаратов для определения их способности ингибировать данный рецептор и предотвратить проникновение HBsAg в клетку печени. Было обнаружено, что ирбесартан, эзетимиб, ритонавир, циклоспорин, производные циклоспорина SCY446 и SCY45O17 и проантоцианидин а так же его аналоги ингибируют связывание HBsAg in vitro. Первое лекарственное средство с подкожным введением, используемое при лечении HDV, представляет собой Myrcludex B (MyrB), миристоилированный синтетический N-ацилированный пептид домена preS1 HBV. В исследовании по безопасности (Blank et al) определили, что концентрация MyrB, которая блокирует вход HBV и HDV, в 100 раз ниже, чем необходимое для ингибирования транспорта желчных кислот. Высокие дозы MyrB (до 20 мг) вводились 36 здоровым добровольцам. Препарат хорошо переносился без признаков токсичности; умеренные и временные возвышения амилазы и липазы наблюдались у семи пациентов, но клинически разрешались спонтанно, без коррекции лечения.
Lonafarnib
Критическим для морфогенеза HDV является процесс пренилирование L-HDAg; Эта стадия необходима для содействия взаимодействию L-HDAg с HBsAg внутри клетки, а ингибирование данного процесса обеспечивает основу для новых терапевтических стратегий.После демонстрации in vitro и на мышиных моделях различные ингибиторы фарнезилтрансферазы уменьшали репликацию HDV. Lonafarnib (LNF) трициклический производный карбоксамида, первоначально испытанный в качестве противоопухолевого агента, был разработан как прототипный ингибитор фарнезилтрансферазы для клинических исследований в лечении HDV.
Полимеры нуклеиновых кислот (NAPs)
NAPs представляют собой отрицательно заряженные молекулы, состоящие из одноэлементных фосфоротиоидных олигонуклеотидов, которые препятствуют начальной неспецифической адсорбции вирусов на поверхности клетки; Исследования на утках, зараженных вирусом гепатита В (DHBV), позволили предположить, что различные NAP способны блокировать проникновение DHBV в утиные гепатоциты и уменьшать секрецию HBsAg. В первом исследовании на людях, NAP REP 2055 и NAP REP 2139 (REP 2139) были проведены на пациентах с HBeAg положительным ХГВ, которые испытывали значительное снижение сывороточного HBsAg. С этой предпосылкой, REP-2139 был выбран для экспериментального исследования для проведения оценки безопасности и эффективности в сочетании с Peg IFN при лечении HDV.
Результаты
Myrcludex B и Lonafarnib
В режиме монотерапии Myrcludex B (Bogomolov et al), оценили MyrB при лечении HDV, чтобы предоставить доказательство того, что блокирование входа HBsAg может предотвратить де-novo HBV-инфекцию еще неинфицированных клеток печени, тем самым уменьшая популяцию HDV-положительных клеток , позволяя гепатоцитам, не содержащим HDV, регенерировать и в конечном итоге приводить к уничтожению вируса. Соответственно, основной конечной точкой исследования был ответ по HBsAg, определяемый как снижение HBsAg в сыворотке по меньшей мере на 0,5 log IU / мл. Препарат вводили семи пациентам в дозе 2 мг ежедневно подкожно в течение 24 недель. Терапия в течение 6 месяцев сопровождалась> 1 log10 снижением HDV-РНК у четырех пациентов, получавших только MyrB; лечение привело к нормализации аланинаминотрансферазы (ALT) у шести пациентов. Однако MyrB не уменьшал титр сывороточного HBsAg; Уровни HDV-РНК восстанавливалась у всех пациентов после лечения.
Lonafarnib: (Koh et al), исследовали препарат для лечения пациентов с показателем фиброза Ishak 3, все HBeAg негативные, с пограничными уровнями ДНК HBV в сыворотке и с уровнями HDV-РНК по крайней мере 10^5 МЕ / мл. Пациенты были рандомизированы на две группы, которые получали пероральный LNF в течение 28 дней и наблюдались в течение 6 месяцев после терапии. Восемь пациентов были зачислены в группу 1; шесть из них получали LNF 200 мг в день и два получали плацебо. Шесть пациентов были отнесены к группе 2; четыре из них получали LNF 400 мг в день и два получали плацебо. После завершения терапии два пациента, получавших плацебо в группе 1, были перенесены в группу 2 и получили 400 мг LNF. К концу терапии, уровень HDV RNA снизился на 0,73 log10 МЕ / мл с более низкой дозой и на 1,54 log10 МЕ / мл с более высокой дозой; снижение было значительно выше, чем в группе плацебо (0,12 log10 МЕ / мл). Сывороточный уровень HBsAg и ALT не изменялись, и РНК HDV возвращалась к исходному уровню у всех пациентов после прекращения терапии. Толерантность была плохой; наиболее важные побочные эффекты имели место с дозой 400 мг и были желудочно-кишечные побочные эффекты (прерывистая рвота в 50%) и потеря веса (в среднем 4 кг).
Поскольку LNF метаболизируется цитохромом P450-3A4,35, ингибитор CPY3A4 ритонавир был добавлен к терапии LNF для уменьшения побочных эффектов и достижения более высокого уровня препарата при более низкой дозировке. Исследования под аббревиатурой LOWR HDV (LOnafarnib With Ritonavir для HDV) продолжаются и до сих пор были представлены в абстрактной форме. В LOWR HDV-2, LNF давали трем пациентам в течение 8 недель в дозе 100 мг BD вместе с ритонавиром 100 мг в день. По сравнению с дозой 100 мг и дозой 300 мг без ритонавира, LNF плюс ритонавир давали налучший антивирусный ответ, что привело к уменьшению HDV-РНК на 3,2 log 10 МЕ / мл после 8 недель терапии; уровни LNF в сыворотке пациентов, получавших ритонавир, были на 4-5 выше по сравнению с LNF без ритонавира. Побочные эффекты были сходны с монотерапией, но в меньшей степени.
В LOWR HDV-4, 15 пациентам был назначен 50 мг LNF с ритонавиром 100 мг в день; ритонавир поддерживали на уровне 100 мг независимо от дозы LNF. Среднее снижение по сравнению с исходным уровнем HDV-РНК составляло 0,98 log10 МЕ / мл на 24 неделе, и оно уменьшилось до> -1,5 log10 МЕ / мл у 58% пациентов. У большинства пациентов был диарея; диарея 3 степени и астения произошли у трех пациентов. Снижение HDV-РНК было связано с рецидивом ДНК HBV у пациентов, которые не получали противовирусную терапию против HBV, что указывает на подавляющее действие HDV на репликацию HBV. Снижение HDV не сохранилось после прекращение терапии, а виремия восстановилась; сывороточный HBsAg не изменился.
Таким образом, как MyrB, так и LNF временно уменьшали уровень HDV-РНК, но их антивирусный эффект не превалировал. Не было обнаружено мутаций HDV к исследуемым препаратам; обе терапии демонстрируют высокий генетический барьер. MyrB нормализовал ALT и имел отличный клинический эффект; LNF не влиял на данный фермент. Не уменьшался и титр сывороточного HBsAg; это было неожиданно для MyrB, так как в соответствии с постулированным механизмом действия первичной конечной точкой исследования должен был быть ответ по HBsAg.
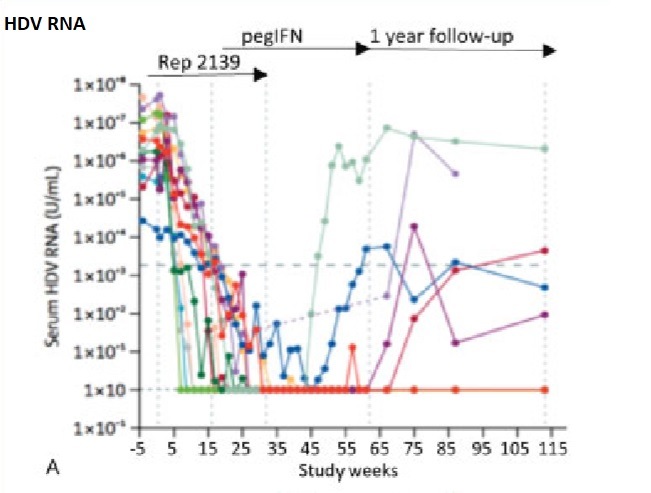
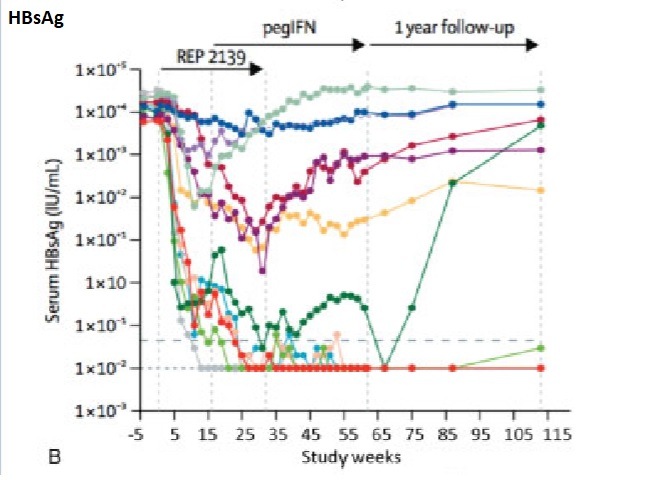
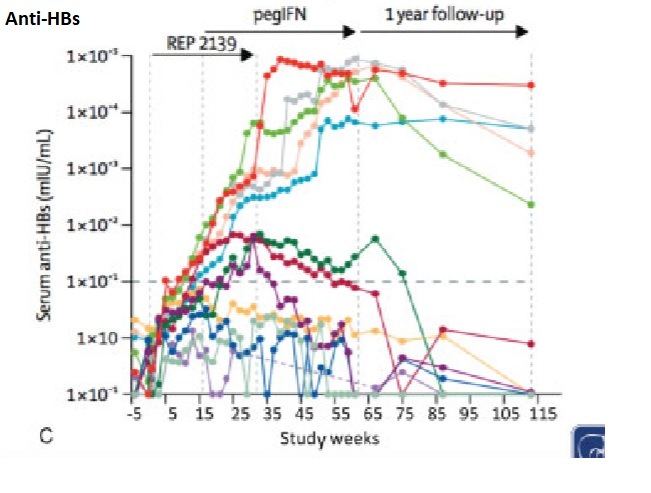
REP-2139 в сочетании с Peg IFN
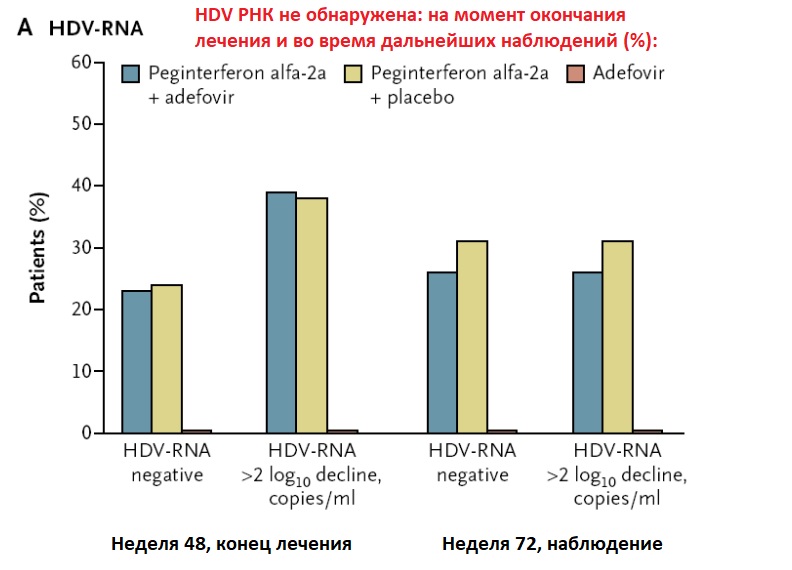
Недавно были опубликованы результаты 2-го этапа концептуального исследования REP 2139 в сочетании с Peg IFN. В исследование было включено 12 пациентов в возрасте от 18 до 55 лет из Молдовы с генотипом 1 HDV-РНК; инфекция была идентифицирована более 17 месяцев. Все были отрицательными по HBeAg, имели отрицательные или низкие уровни ДНК HBV и, как сообщается, имели хронический гепатит без цирроза; цирроз был исключен по печеночным и гематологическим параметрам, абдоминальному ультразвуку (УЗИ) и жесткости печени (KPa <10 у семи пациентов,> 10 у пяти пациентов). Концентрация HBsAg в сыворотке в начале исследования составляла> 1000 МЕ / мл. Пациенты получали 500 мг внутривенно REP 2139 один раз в неделю в течение 15 недель, а затем 250 мг внутривенно REP 2139 в сочетании с 180 мкг подкожного Peg IFN один раз в неделю в течение 15 недель, а затем монотерапией Peg IFN 180 мкг один раз в неделю в течение 33 недель. Их контролировали на протяжении 1 года после терапии. Одиннадцать пациентов стали HDV-РНК отрицательными во время лечения, при этом HDV-РНК резко уменьшалась с первых недель монотерапии REP; девять были отрицательными в конце лечения и семь в конце наблюдения.
В конце наблюдения девять пациентов имели нормальные сывороточные уровни аминотрансферазы (АЛТ). У шестерых, уровень HBsAg снизился до <0,05 МЕ / мл к концу лечения; пять пациентов поддерживали ответ по HBsAg в конце наблюдения.
Были зарегистрированы различные побочные эффекты, связанные главным образом с токсичностью PEG IFN. Пирексия, озноб и астения наблюдались у 100%, 75%, 67% пациентов, соответственно. У восьми пациентов наблюдалась нейтропения (67%), у 10 пациентов тромбоцитопения (83%), требующая введения Eltrombopag у двух пациентов. У 5 пациентов (42%) АЛТ увеличивалась во время терапии; по сообщениям, повышение уровня фермента было клинически без осложнений.
Серьезных нежелательных явлений не было описано во время исследований REP 2139. Шесть пациентов разработали антитела к HBsAg (анти-HBs), титры превышали 7681 мМЕ / мл после введения Peg IFN; у пяти все еще были антитела в конце наблюдения.
Выводы
Новые препараты, нацеленные на HDV, скорее всего, приведут к лучшему контролю гепатита D в ближайшие годы. Предварительные данные по REP 2139 / Peg IFN являются наиболее перспективными. Если это подтвердится в более крупных, хорошо спроектированных и рандомизированных исследованиях, эта терапевтическая стратегия обеспечит прорыв, по сравнению с терапией на основе IFN-α; однако биологический фон терапии REP 2139 в настоящее время плохо изучен, и молекулярный механизм, с помощью которого лекарство оказывает терапевтический эффект, должен быть выяснен, чтобы дать обоснование для оптимизации терапии. С новыми препаратами количество пациентов, излеченных от гепатита D мы надеемся увеличить. Тем не менее, управление пациентами, которые не имеют ответа по HDV или не теряют HBsAg, независимо от кинетики HDV-РНК, останется проблематичным. Можно ожидать, что доля пациентов с отрицательными HDV-РНК и HBsAg будет увеличиваться по сравнению с лечением монотерапией ИФН; дилемма заключается в том, как долго должны эти пациенты лечиться и может ли HDV / HBsAg в конечном итоге быть искоренена путем расширения терапии. Если HDV РНК становится не обнаруживаемой, но HBsAg остается неизменным, требуется длительное клинически беспрецедентное наблюдение, чтобы сделать вывод о том, что лечение привело к искоренению HDV: на сколько долгим требуется наблюдение необходимо установить, а тем временем вирусологические рецидивы происходили и спустя годы после, казалось бы, вирусологического ответа. Длительное лечение повысит проблему толерантности и безопасности, в частности, в сочетании с плохо переносимым ИФН-α; IFN-λ может служить альтернативой, так как этот цитокин, как предполагается, вызывает меньше побочных эффектов, чем IFN-α, и может быть более подходящим для длительных методов лечения. Текущие и будущие испытания покажут, могут ли новые лекарственные средства еще больше увеличить шансы эрадикации HDV в течение разумных сроков лечения.
Советуем прочитать:


