ILC - 2019 - конференция EASL
- Nessi
- Бывалый
- Сообщения: 1116
- Зарегистрирован: 15 апр 2014 21:56
- Пол: ♀
- Гепатит: C
- Фиброз: F1
- Генотип: 1
- Город: Non
- Благодарил (а): 30 раз
- Поблагодарили: 296 раз
ILC - 2019 - конференция EASL
Буду очень признательна, если кто-то озвучит слайды, у меня сейчас совсем нет такой возможности. Хотя бы ленту бегом просмотреть успеть.
- Nessi
- Бывалый
- Сообщения: 1116
- Зарегистрирован: 15 апр 2014 21:56
- Пол: ♀
- Гепатит: C
- Фиброз: F1
- Генотип: 1
- Город: Non
- Благодарил (а): 30 раз
- Поблагодарили: 296 раз
ILC - 2019 - конференция EASL
Expertly presented by @kmdrysdale NHS England data of over 14,000 patients who completed treatment and attended for SVR bloods. No difference in regimens for non cirrhotic patients. For those with cirrhosis sof/vel inferior to sof/vel/RBV.
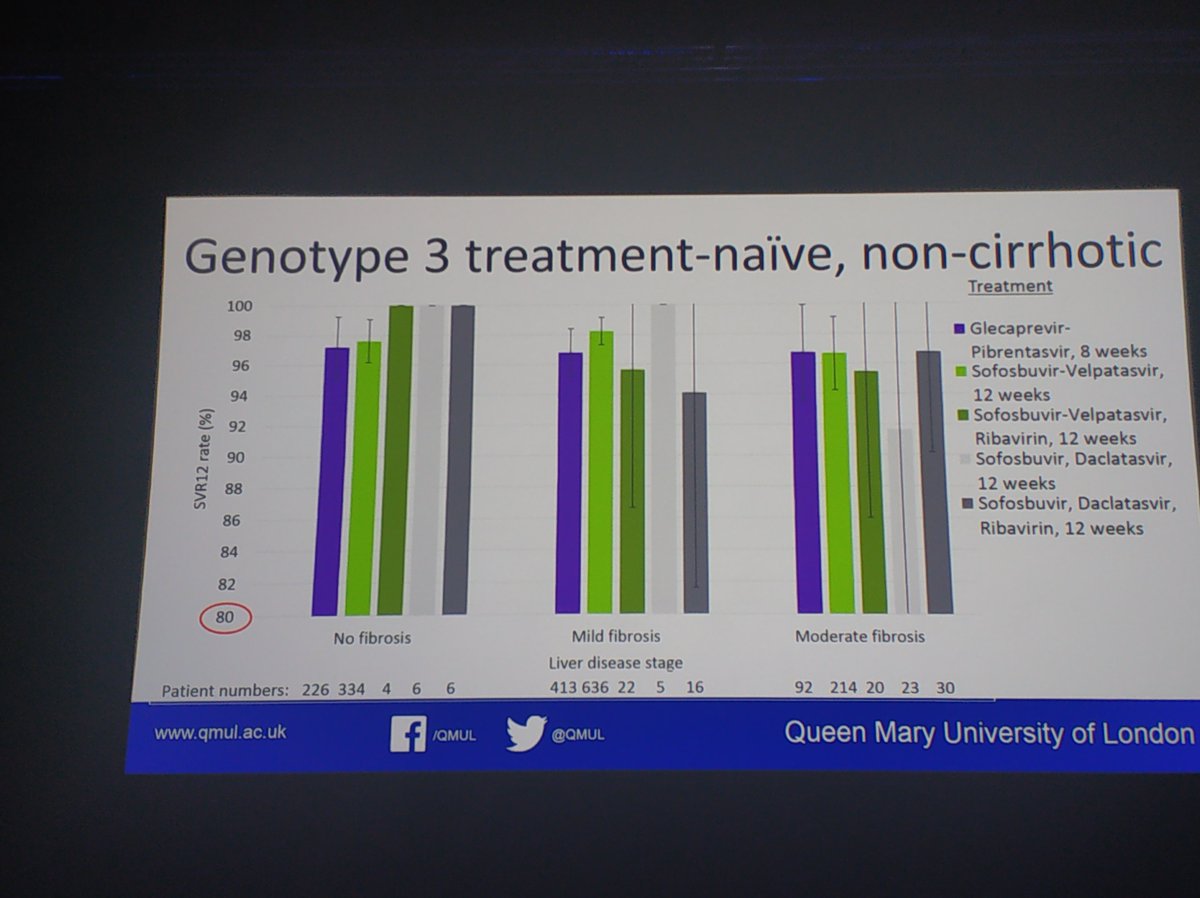
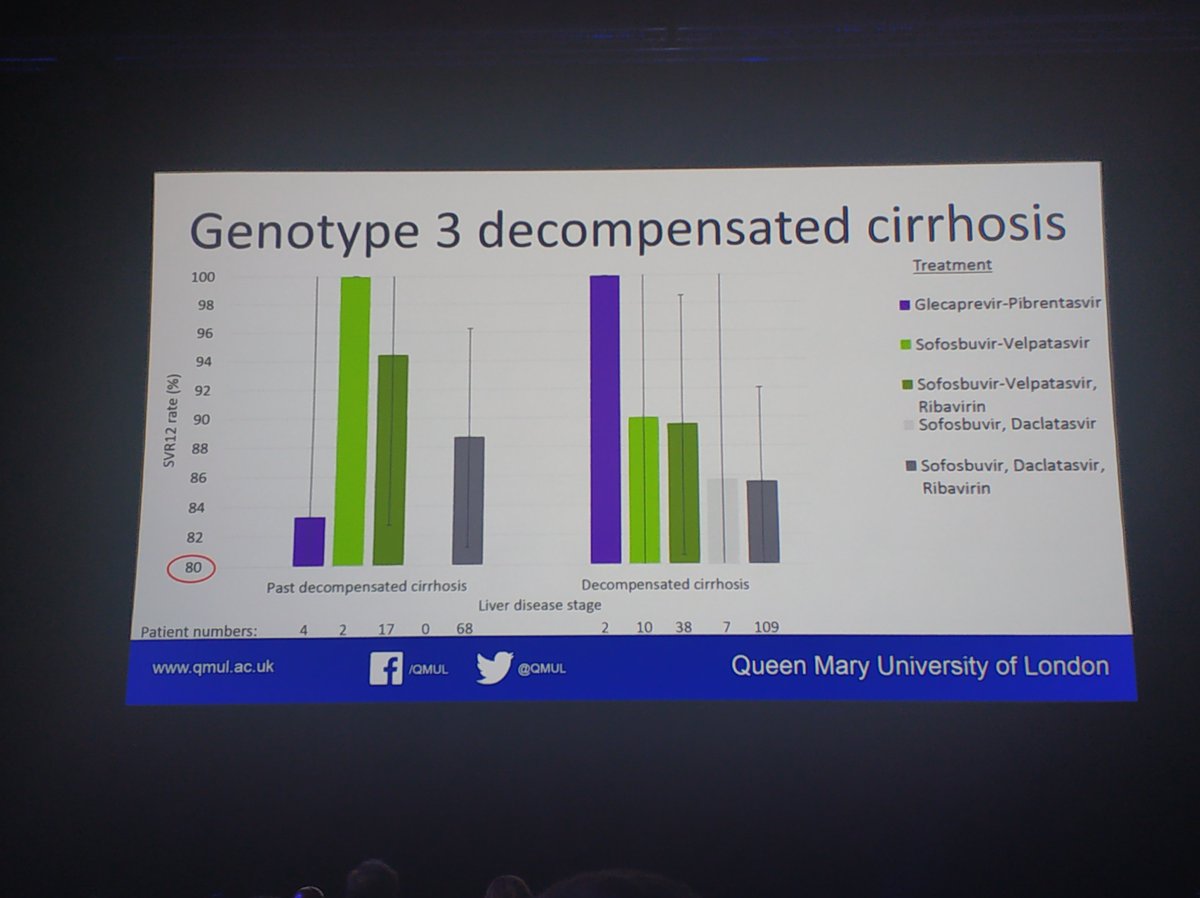
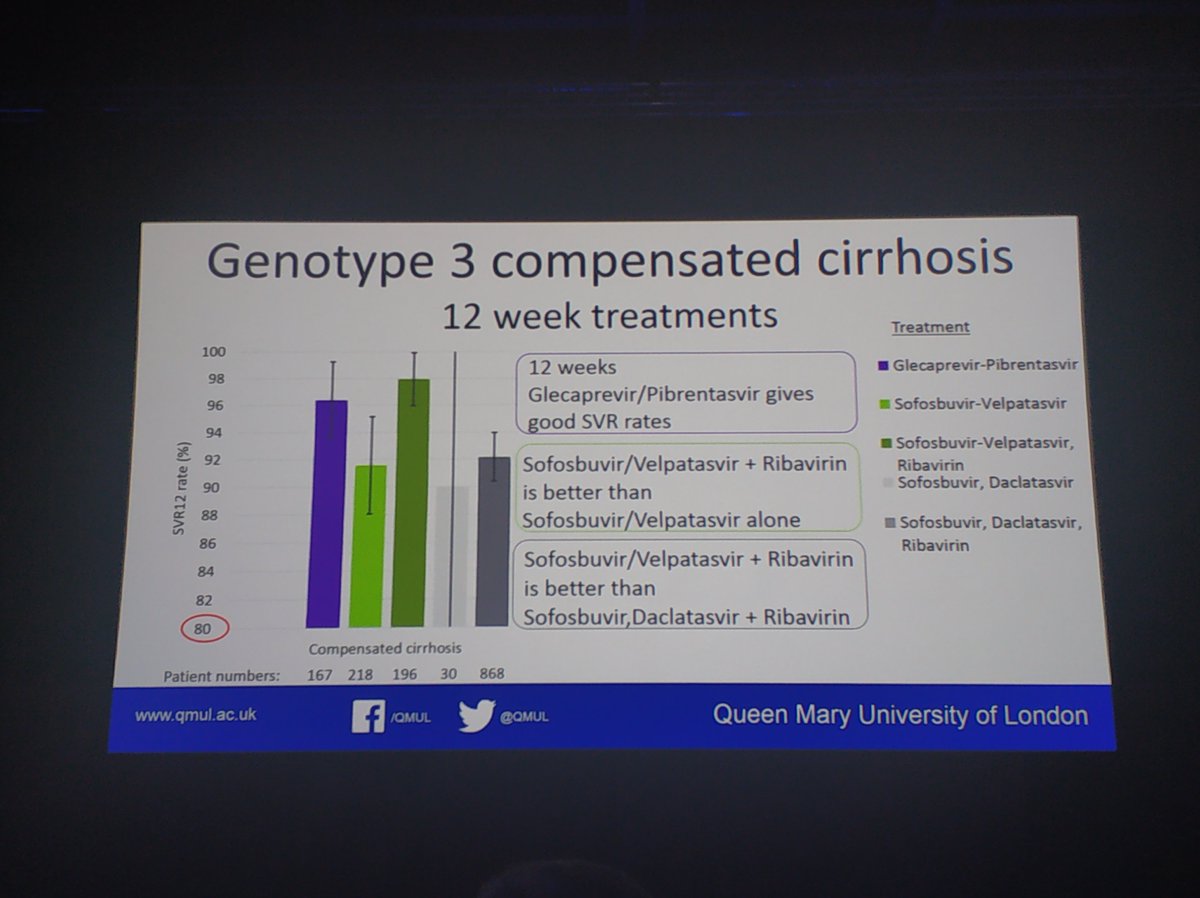



- Nessi
- Бывалый
- Сообщения: 1116
- Зарегистрирован: 15 апр 2014 21:56
- Пол: ♀
- Гепатит: C
- Фиброз: F1
- Генотип: 1
- Город: Non
- Благодарил (а): 30 раз
- Поблагодарили: 296 раз
ILC - 2019 - конференция EASL
Also nice data demonstrating faster progression to cirrhosis amongst GT3 compared to others


- Nessi
- Бывалый
- Сообщения: 1116
- Зарегистрирован: 15 апр 2014 21:56
- Пол: ♀
- Гепатит: C
- Фиброз: F1
- Генотип: 1
- Город: Non
- Благодарил (а): 30 раз
- Поблагодарили: 296 раз
ILC - 2019 - конференция EASL
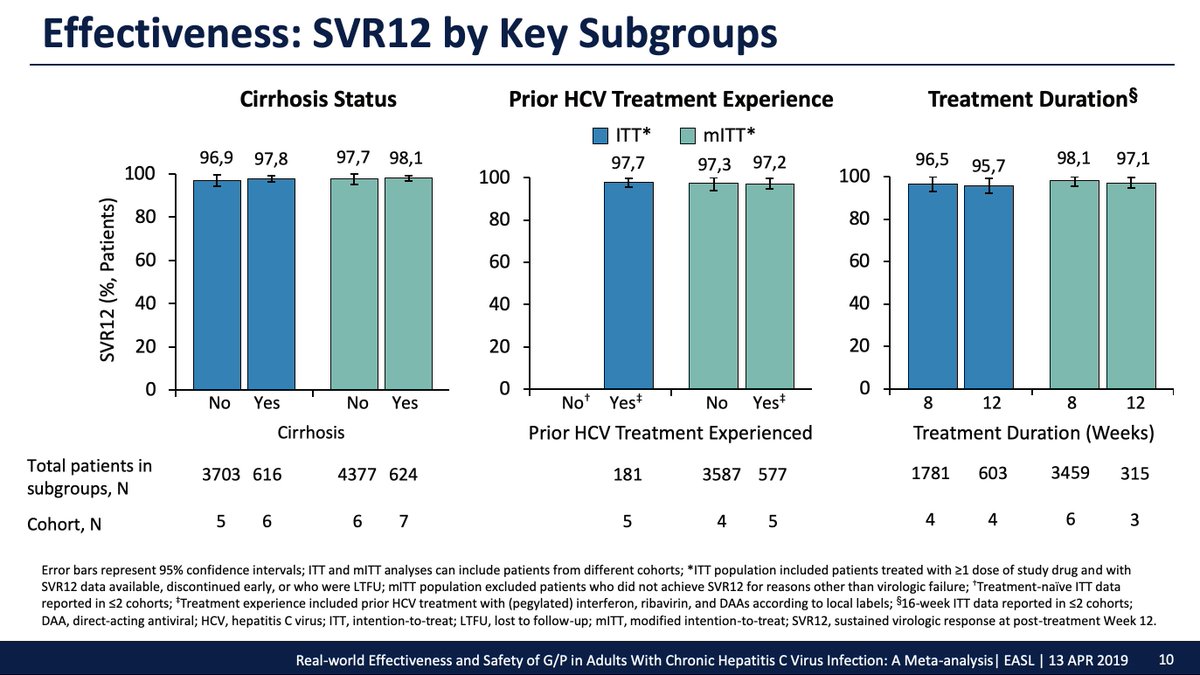
Real-world data on more than 8000 #HepatitisC patients treated with GLE/PIB confirms a high SVR rate irrespective of genotype, liver fibrosis or prior treatment. Even GT3 patients achieved >95% SVR.
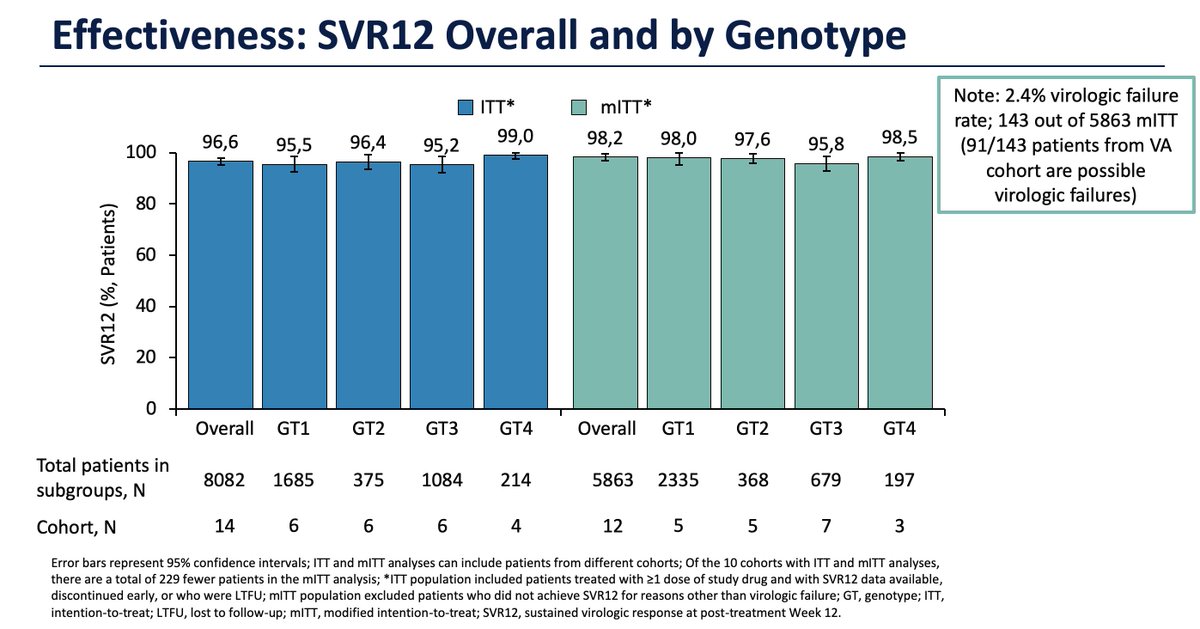


- Nessi
- Бывалый
- Сообщения: 1116
- Зарегистрирован: 15 апр 2014 21:56
- Пол: ♀
- Гепатит: C
- Фиброз: F1
- Генотип: 1
- Город: Non
- Благодарил (а): 30 раз
- Поблагодарили: 296 раз
ILC - 2019 - конференция EASL
Russia: a lack of registered paediatric formulations (which is a regulatory requirement in the country) for HepC cure is a major barrier, not to mention the high prices.




-
tretjak

- Новичок
- Сообщения: 496
- Зарегистрирован: 13 авг 2018 21:34
- Пол: ♂
- Гепатит: C
- Фиброз: F4
- Генотип: 3
- Город: харьков
- Благодарил (а): 50 раз
- Поблагодарили: 71 раз
ILC - 2019 - конференция EASL
ничего не понятно
гепатит с.генотип 3 ав.фиброз F 4.начало пвт 15.08.2018.вирусная нагрузка 4,9х10^6.соф+вел+рибавирин 3+3 таблетки
22.08-вир нагр 3,4х10^2 10.09.18.-пцр колич. -отрицательно,пцр кач.-0. 8.10.18-пцр кач.отрицательно.
12нед.-пцр качество не обнаружено.16 недель-пцр качество-не обнаружено.
20нед.-пцр качество не обнаружено 29.01.19.-финиш 31.01. пцр качество-отрицательно
2.04.19.-уво12. алт-62,аст-42
22.08-вир нагр 3,4х10^2 10.09.18.-пцр колич. -отрицательно,пцр кач.-0. 8.10.18-пцр кач.отрицательно.
12нед.-пцр качество не обнаружено.16 недель-пцр качество-не обнаружено.
20нед.-пцр качество не обнаружено 29.01.19.-финиш 31.01. пцр качество-отрицательно
2.04.19.-уво12. алт-62,аст-42
-
Kat
- Новичок
- Сообщения: 200
- Зарегистрирован: 01 июл 2018 18:06
- Пол: ♀
- Гепатит: C
- Фиброз: F1
- Генотип: 3
- Город: Москва
- Благодарил (а): 153 раза
- Поблагодарили: 21 раз
ILC - 2019 - конференция EASL
Не понятно, но очень интересно бы узнать..
Ген 3, примерно с 2000г, F1
Соф/Дак Биокон
Начала 29.01.2019/ начало 31.05.2019
Пцр через 2 недели - минус
Соф/Дак Биокон
Начала 29.01.2019/ начало 31.05.2019
Пцр через 2 недели - минус
-
Little sister
- Новичок
- Сообщения: 203
- Зарегистрирован: 05 мар 2019 09:48
- Пол: ♀
- Гепатит: C
- Фиброз: F0
- Генотип: 1
- Город: Пушкино
- Благодарил (а): 112 раз
- Поблагодарили: 118 раз
ILC - 2019 - конференция EASL
А я вобще ничего не понимаю)
Геп С 1ген F0
ПВТ Sof/led
начало 05.03.2019
6 недель ПЦР "+" (на границе чуйки)
8 недель ПЦР "-"


Финиш 27.05.2019
МОЯ ТЕМА viewtopic.php?f=26&t=24658
ПВТ Sof/led
начало 05.03.2019
6 недель ПЦР "+" (на границе чуйки)
8 недель ПЦР "-"
Финиш 27.05.2019
МОЯ ТЕМА viewtopic.php?f=26&t=24658
- Nessi
- Бывалый
- Сообщения: 1116
- Зарегистрирован: 15 апр 2014 21:56
- Пол: ♀
- Гепатит: C
- Фиброз: F1
- Генотип: 1
- Город: Non
- Благодарил (а): 30 раз
- Поблагодарили: 296 раз
ILC - 2019 - конференция EASL
Гугл-перевод:
Булевиртид, ранее известный как Myrcludex B, привел к подавлению вируса гепатита В (HDV) и функциональному излечению вируса гепатита B (HBV) у некоторых людей с обоими вирусами в сочетании с пегилированным интерфероном-альфа-2a, согласно презентации в Международный конгресс печени 2019 года на прошлой неделе в Вене.
«Результаты этого исследования показывают, что булевиртид является многообещающим средством лечения хронической инфекции HDV, и что комбинация булевиртида и peg-IFN-альфа обладает потенциалом для лечения ко-инфекции HBV / HDV у некоторых пациентов», - сказал профессор Хайнер Ведемейер. Университетской больницы Эссена в Германии.
Дельта гепатита является дефектным вирусом, который может размножаться только в присутствии ВГВ. В течение многих лет или десятилетий хронический гепатит В может привести к прогрессирующему заболеванию печени, включая цирроз печени, рак печени и терминальную стадию печеночной недостаточности. Прогрессирование заболевания печени более агрессивно у людей с коинфекцией HBV / HDV, чем у людей с одним HBV.
В настоящее время не существует одобренной терапии HDV, хотя иногда ее лечат пег-ИФН-альфа. Нуклеозидные / нуклеотидные противовирусные препараты против гепатита В, такие как тенофовир дисопроксилфумарат ( Viread ), тенофовир алафенамид ( Vemlidy ) и энтекавир ( Baraclude ), могут подавлять репликацию HBV во время терапии, но обычно не приводят к излечению, как показано поверхностным антигеном гепатита B (HBsAg) клиренс и сероконверсия антител.
Булевиртид представляет собой экспериментальный ингибитор проникновения, который связывается с рецептором HBV, используемым для проникновения в клетки печени (известный как ко-транспортный полипептид таурохолата натрия или NTCP), тем самым одновременно вмешиваясь в жизненный цикл HBV и предотвращая репликацию HDV.
Ведемейер представил результаты клинического испытания фазы 2b, в котором оценивали безопасность и эффективность булевиртида и пегилированного интерферона-альфа-2а. На прошлогодней встрече EASL он представил исследование булевиртида в сочетании с тенофовиром DF. Это исследование показало, что, хотя булевиртид подавлял репликацию HBV и HDV, он обычно не приводил к излечению.
В настоящее исследование было включено 60 человек с коинфекцией HBV / HDV. Они были случайным образом распределены по четырем лечебным группам:
180 мкг пег-ИФН-альфа-2а в одиночку
2 мг булевиртида плюс пег-ИФН-альфа-2а
5 мг булевиртида плюс пег-ИФН-альфа-2а
2 мг булевиртида в одиночку.
Пег-ИФН-альфа-2а вводили подкожной инъекцией один раз в неделю, а булевиртид - в виде ежедневной инъекции. Все участники получали лечение в течение 48 недель с 24-недельным периодом наблюдения после завершения терапии.
Уровни вирусной нагрузки HDV резко падали во время лечения в двух группах комбинированной терапии и умеренно в группах монотерапии булевиртидом и пег-ИФН-альфа. Но в то время как уровни РНК HDV восстановились после прекращения лечения в комбинации с двумя монотерапиями и 5 мг, она оставалась подавленной в комбинации 2 мг, сообщил Ведемейер.
Девять из 15 человек (60%), принимавших 2 мг булевритида, и шесть из 15 (40%), принимавших 5 мг комбо, достигли неопределяемой РНК HDV к концу лечения на 48 неделе по сравнению с двумя людьми (13%) в каждой группе монотерапии , Через 72 недели восемь (53%) и четыре (27%) человека в соответствующих комбинированных группах все еще подавляли ВПЧ, но никто в монотерапевтических группах не подавлял их.
Кроме того, шесть из 15 человек в комбинированной группе по 2 мг и двое из 15 в комбинированной группе по 5 мг имели снижение более чем на 1 log или неопределяемый HBsAg на неделе 72. Если рассматривать обе комбинации вместе, 27% имели потерю HBsAg и 20 % испытали сероконверсию, считающуюся функциональным излечением, по словам Ведемейера. Ни у кого, принимавшего монотерапию, не было потери HBsAg или сероконверсии.
Нормализация ферментов печени ALT наблюдалась у 37% людей, принимавших комбинации, и у 67% тех, кто принимал только булевиртид, через 48 недель. Но в то время как нормализация ALT поддерживалась в комбинированных группах, она была потеряна в группе монотерапии булевиртидом.
Лечение в целом было безопасным и хорошо переносимым. Как сообщал Ведемейер, в течение периода лечения не наблюдалось серьезных побочных эффектов и не было прекращений из-за побочных эффектов, связанных с булевиртидом. В течение недели 72 наблюдалось 155 побочных эффектов, связанных с булевиртидом, большинство из которых были легкими. Соли желчи увеличились во время лечения, но вернулись к норме вскоре после прекращения терапии. Большинство неблагоприятных событий были связаны с peg-IFN-альфа, который, как известно, трудно переносить.
«Ингибирование входа с помощью [bulevirtide] в сочетании с [peg-IFN-alfa-2a] обладает лечебным потенциалом у пациентов с хронической совместной инфекцией гепатита B / D», - заключили исследователи. «Представленные данные указывают на будущую роль лечения хронического гепатита В.»
Ведемейер отметил, что это крупнейшее клиническое исследование и лучшие результаты, когда-либо наблюдавшиеся для HDV. Учитывая, что уровни вируса восстановились после прекращения терапии, он сказал, что более длительные сроки лечения будут изучены в исследованиях фазы III.
Булевиртид, ранее известный как Myrcludex B, привел к подавлению вируса гепатита В (HDV) и функциональному излечению вируса гепатита B (HBV) у некоторых людей с обоими вирусами в сочетании с пегилированным интерфероном-альфа-2a, согласно презентации в Международный конгресс печени 2019 года на прошлой неделе в Вене.
«Результаты этого исследования показывают, что булевиртид является многообещающим средством лечения хронической инфекции HDV, и что комбинация булевиртида и peg-IFN-альфа обладает потенциалом для лечения ко-инфекции HBV / HDV у некоторых пациентов», - сказал профессор Хайнер Ведемейер. Университетской больницы Эссена в Германии.
Дельта гепатита является дефектным вирусом, который может размножаться только в присутствии ВГВ. В течение многих лет или десятилетий хронический гепатит В может привести к прогрессирующему заболеванию печени, включая цирроз печени, рак печени и терминальную стадию печеночной недостаточности. Прогрессирование заболевания печени более агрессивно у людей с коинфекцией HBV / HDV, чем у людей с одним HBV.
В настоящее время не существует одобренной терапии HDV, хотя иногда ее лечат пег-ИФН-альфа. Нуклеозидные / нуклеотидные противовирусные препараты против гепатита В, такие как тенофовир дисопроксилфумарат ( Viread ), тенофовир алафенамид ( Vemlidy ) и энтекавир ( Baraclude ), могут подавлять репликацию HBV во время терапии, но обычно не приводят к излечению, как показано поверхностным антигеном гепатита B (HBsAg) клиренс и сероконверсия антител.
Булевиртид представляет собой экспериментальный ингибитор проникновения, который связывается с рецептором HBV, используемым для проникновения в клетки печени (известный как ко-транспортный полипептид таурохолата натрия или NTCP), тем самым одновременно вмешиваясь в жизненный цикл HBV и предотвращая репликацию HDV.
Ведемейер представил результаты клинического испытания фазы 2b, в котором оценивали безопасность и эффективность булевиртида и пегилированного интерферона-альфа-2а. На прошлогодней встрече EASL он представил исследование булевиртида в сочетании с тенофовиром DF. Это исследование показало, что, хотя булевиртид подавлял репликацию HBV и HDV, он обычно не приводил к излечению.
В настоящее исследование было включено 60 человек с коинфекцией HBV / HDV. Они были случайным образом распределены по четырем лечебным группам:
180 мкг пег-ИФН-альфа-2а в одиночку
2 мг булевиртида плюс пег-ИФН-альфа-2а
5 мг булевиртида плюс пег-ИФН-альфа-2а
2 мг булевиртида в одиночку.
Пег-ИФН-альфа-2а вводили подкожной инъекцией один раз в неделю, а булевиртид - в виде ежедневной инъекции. Все участники получали лечение в течение 48 недель с 24-недельным периодом наблюдения после завершения терапии.
Уровни вирусной нагрузки HDV резко падали во время лечения в двух группах комбинированной терапии и умеренно в группах монотерапии булевиртидом и пег-ИФН-альфа. Но в то время как уровни РНК HDV восстановились после прекращения лечения в комбинации с двумя монотерапиями и 5 мг, она оставалась подавленной в комбинации 2 мг, сообщил Ведемейер.
Девять из 15 человек (60%), принимавших 2 мг булевритида, и шесть из 15 (40%), принимавших 5 мг комбо, достигли неопределяемой РНК HDV к концу лечения на 48 неделе по сравнению с двумя людьми (13%) в каждой группе монотерапии , Через 72 недели восемь (53%) и четыре (27%) человека в соответствующих комбинированных группах все еще подавляли ВПЧ, но никто в монотерапевтических группах не подавлял их.
Кроме того, шесть из 15 человек в комбинированной группе по 2 мг и двое из 15 в комбинированной группе по 5 мг имели снижение более чем на 1 log или неопределяемый HBsAg на неделе 72. Если рассматривать обе комбинации вместе, 27% имели потерю HBsAg и 20 % испытали сероконверсию, считающуюся функциональным излечением, по словам Ведемейера. Ни у кого, принимавшего монотерапию, не было потери HBsAg или сероконверсии.
Нормализация ферментов печени ALT наблюдалась у 37% людей, принимавших комбинации, и у 67% тех, кто принимал только булевиртид, через 48 недель. Но в то время как нормализация ALT поддерживалась в комбинированных группах, она была потеряна в группе монотерапии булевиртидом.
Лечение в целом было безопасным и хорошо переносимым. Как сообщал Ведемейер, в течение периода лечения не наблюдалось серьезных побочных эффектов и не было прекращений из-за побочных эффектов, связанных с булевиртидом. В течение недели 72 наблюдалось 155 побочных эффектов, связанных с булевиртидом, большинство из которых были легкими. Соли желчи увеличились во время лечения, но вернулись к норме вскоре после прекращения терапии. Большинство неблагоприятных событий были связаны с peg-IFN-альфа, который, как известно, трудно переносить.
«Ингибирование входа с помощью [bulevirtide] в сочетании с [peg-IFN-alfa-2a] обладает лечебным потенциалом у пациентов с хронической совместной инфекцией гепатита B / D», - заключили исследователи. «Представленные данные указывают на будущую роль лечения хронического гепатита В.»
Ведемейер отметил, что это крупнейшее клиническое исследование и лучшие результаты, когда-либо наблюдавшиеся для HDV. Учитывая, что уровни вируса восстановились после прекращения терапии, он сказал, что более длительные сроки лечения будут изучены в исследованиях фазы III.
-
Pacha33
- Местный
- Сообщения: 967
- Зарегистрирован: 26 ноя 2017 21:51
- Пол: ♂
- Гепатит: В
- Фиброз: F0
- Генотип: не определял(а)
- Город: Питер
- Благодарил (а): 98 раз
- Поблагодарили: 230 раз
ILC - 2019 - конференция EASL
Экспериментальный ингибитор корового белка вируса гепатита B (HBV) привел к большему снижению вирусной нагрузки HBV и остаточного генетического материала HBV при добавлении к аналогам нуклеозидов / нуклеотидов, что может привести к функциональному излечению с более длительным последующим наблюдением, согласно исследованию, представленному на Международном конгрессе печени 2019 года на прошлой неделе в Вене.
ABI-H0731, от Assembly Biosciences, хорошо переносился, и быстрое, глубокое снижение HBV DNA и HBV RNA могло способствовать потере cccDNA (ковалентно замкнутой кольцевой ДНК), промежуточной формы, которая сохраняется в ядре клеток печени и представляет барьер для лечения, сказал доктор Джей Лалезари из Quest Clinical Research в Сан-Франциско.
CccDNA HBV может бездействовать в клетках печени, создавая резервуар вирусного генетического материала, который уклоняется как от иммунной системы, так и от стандартного лечения. В течение многих лет или десятилетий хроническая инфекция ВГВ может приводить к циррозу печени, гепатоцеллюлярной карциноме и терминальной стадии печеночной недостаточности, требующей пересадки.
Нуклеозидные / нуклеотидные противовирусные препараты, такие как тенофовир дисипроксилфумарат ( Viread ), тенофовир алафенамид ( Vemlidy ) и энтекавир ( Baraclude ), могут подавлять репликацию HBV во время длительной терапии, но они не полностью устраняют вирус, не предотвращают образование cccDNA и обычно делают не приводит к излечению, о чем свидетельствует потеря поверхностного антигена гепатита В (HBsAg).
ABI-H0731 является аллостерическим модификатором корового белка (CpAM), который нацелен на коровый белок HBV и препятствует множественным стадиям жизненного цикла вируса, включая образование cccDNA.
Доктор Лалезари представил промежуточные результаты из пары исследований фазы IIa, оценивающих ABI-H0731 у людей с хроническим гепатитом B и отсутствующим или умеренным (стадия F0-F2) фиброзом печени.
Исследование 201 включало 47 положительных по антигену гепатита B 'H' (HBeAg) и 26 отрицательных по HBeAg людей на нуклеозидные / нуклеотидные аналоги (в основном, тенофовир) с подавленной ДНК HBV. Они были рандомизированы для добавления перорально ABI-H0731 один раз в день или плацебо.
В исследование 202 вошли 25 ранее не леченных HBeAg-позитивных людей с неподавленным ВГВ. Они были рандомизированы для получения энтекавира плюс либо ABI-H0731, либо плацебо. Через 24 недели люди в обоих исследованиях могут присоединиться к продолжающемуся открытому расширенному исследованию (исследование 211).
В обоих исследованиях комбинированный режим привел к более быстрому, крутому и большему снижению вирусной нагрузки HBV, начиная со 2-й недели. В исследовании 201 пациенты, добавившие ABI-H0731, имели среднее снижение РНК HBV на уровне 2,34 log 10 на 12 неделе по сравнению с 0,05 log 10 в группе плацебо. Хотя большинство людей еще не достигли этой временной точки, снижение через 24 недели составило 2,20 log 10 и 0,15 log 10 соответственно.
В исследовании 202 - у тех, кто начал лечение неподдерживаемым вирусом - ДНК ВГВ снизилась на 4,54 log 10 на неделе 12 и на 5,94 log 10 на неделе 24 в группе комбинированной терапии по сравнению с 3,29 10 log и 3,99 log 10 соответственно в энтекавир монотерапевтическая группа. Если посмотреть на РНК HBV, уровни снизились на 2,27 log 10 на неделе 12 и 2,54 log 10 на неделе 12 в комбинированной группе против 0,44 log 10 и 0,61 log 10 , соответственно, в группе, принимавшей только энтекавир.
Среди участников исследования 201, которые достигли 24-недельного временного интервала, чувствительные тесты для выявления ДНК HBV низкого уровня, способной измерять до 2-5 МЕ / мл, показали, что остаточный вирус не был удален с использованием одних аналогов нуклеозидов / нуклеотидов, но упал ниже уровня обнаружения у пяти из шести человек, добавивших ABI-H0731.
Лечение в целом было безопасным и хорошо переносимым, и о серьезных побочных эффектах, перерывах в лечении или прекращении лечения не сообщалось.
По словам Лалезари, устранение остаточной ДНК вируса гепатита B, вероятно, потребуется для предотвращения образования новой cccDNA, и это станет важной вехой в лечении. Он сказал, что распад cccDNA и снижение уровня HBeAg и HBsAg, как ожидается, последуют за устранением остаточного вируса, и это будет рассмотрено в дополнительном исследовании.
«Хотя в обоих исследованиях наблюдалось снижение уровня HBeAg и HBsAg у некоторых людей, слишком рано делать осмысленные выводы об этой конечной точке», - сказал Лалезари в пресс-релизе конференции . «Ускоренное снижение и значительная потеря базовой РНК и виремии ДНК позволяют предположить, что комбинированная терапия с основным ингибитором плюс [нуклеозид / нуклеотидные аналоги] может усилить потерю cccDNA и вирусного антигена после того, как остаточная виремия будет полностью очищена».
Несмотря на эти многообещающие результаты, Ассамблея, по сообщениям, решила не продолжать разработку ABI-H0731 в пользу более мощных ингибиторов белка ядра, включая ABI-H2158 и ABI-H3733. В последнем плакате на конференции сообщалось, что ABI-H2158 хорошо переносился и продемонстрировал благоприятную фармакокинетику в исследовании фазы Ia; в настоящее время проводится исследование по выявлению дозы в фазе Ib . По сообщению компании, ABI-H3733, как ожидается, начнет исследования фазы Ia в начале следующего года.
ABI-H0731, от Assembly Biosciences, хорошо переносился, и быстрое, глубокое снижение HBV DNA и HBV RNA могло способствовать потере cccDNA (ковалентно замкнутой кольцевой ДНК), промежуточной формы, которая сохраняется в ядре клеток печени и представляет барьер для лечения, сказал доктор Джей Лалезари из Quest Clinical Research в Сан-Франциско.
CccDNA HBV может бездействовать в клетках печени, создавая резервуар вирусного генетического материала, который уклоняется как от иммунной системы, так и от стандартного лечения. В течение многих лет или десятилетий хроническая инфекция ВГВ может приводить к циррозу печени, гепатоцеллюлярной карциноме и терминальной стадии печеночной недостаточности, требующей пересадки.
Нуклеозидные / нуклеотидные противовирусные препараты, такие как тенофовир дисипроксилфумарат ( Viread ), тенофовир алафенамид ( Vemlidy ) и энтекавир ( Baraclude ), могут подавлять репликацию HBV во время длительной терапии, но они не полностью устраняют вирус, не предотвращают образование cccDNA и обычно делают не приводит к излечению, о чем свидетельствует потеря поверхностного антигена гепатита В (HBsAg).
ABI-H0731 является аллостерическим модификатором корового белка (CpAM), который нацелен на коровый белок HBV и препятствует множественным стадиям жизненного цикла вируса, включая образование cccDNA.
Доктор Лалезари представил промежуточные результаты из пары исследований фазы IIa, оценивающих ABI-H0731 у людей с хроническим гепатитом B и отсутствующим или умеренным (стадия F0-F2) фиброзом печени.
Исследование 201 включало 47 положительных по антигену гепатита B 'H' (HBeAg) и 26 отрицательных по HBeAg людей на нуклеозидные / нуклеотидные аналоги (в основном, тенофовир) с подавленной ДНК HBV. Они были рандомизированы для добавления перорально ABI-H0731 один раз в день или плацебо.
В исследование 202 вошли 25 ранее не леченных HBeAg-позитивных людей с неподавленным ВГВ. Они были рандомизированы для получения энтекавира плюс либо ABI-H0731, либо плацебо. Через 24 недели люди в обоих исследованиях могут присоединиться к продолжающемуся открытому расширенному исследованию (исследование 211).
В обоих исследованиях комбинированный режим привел к более быстрому, крутому и большему снижению вирусной нагрузки HBV, начиная со 2-й недели. В исследовании 201 пациенты, добавившие ABI-H0731, имели среднее снижение РНК HBV на уровне 2,34 log 10 на 12 неделе по сравнению с 0,05 log 10 в группе плацебо. Хотя большинство людей еще не достигли этой временной точки, снижение через 24 недели составило 2,20 log 10 и 0,15 log 10 соответственно.
В исследовании 202 - у тех, кто начал лечение неподдерживаемым вирусом - ДНК ВГВ снизилась на 4,54 log 10 на неделе 12 и на 5,94 log 10 на неделе 24 в группе комбинированной терапии по сравнению с 3,29 10 log и 3,99 log 10 соответственно в энтекавир монотерапевтическая группа. Если посмотреть на РНК HBV, уровни снизились на 2,27 log 10 на неделе 12 и 2,54 log 10 на неделе 12 в комбинированной группе против 0,44 log 10 и 0,61 log 10 , соответственно, в группе, принимавшей только энтекавир.
Среди участников исследования 201, которые достигли 24-недельного временного интервала, чувствительные тесты для выявления ДНК HBV низкого уровня, способной измерять до 2-5 МЕ / мл, показали, что остаточный вирус не был удален с использованием одних аналогов нуклеозидов / нуклеотидов, но упал ниже уровня обнаружения у пяти из шести человек, добавивших ABI-H0731.
Лечение в целом было безопасным и хорошо переносимым, и о серьезных побочных эффектах, перерывах в лечении или прекращении лечения не сообщалось.
По словам Лалезари, устранение остаточной ДНК вируса гепатита B, вероятно, потребуется для предотвращения образования новой cccDNA, и это станет важной вехой в лечении. Он сказал, что распад cccDNA и снижение уровня HBeAg и HBsAg, как ожидается, последуют за устранением остаточного вируса, и это будет рассмотрено в дополнительном исследовании.
«Хотя в обоих исследованиях наблюдалось снижение уровня HBeAg и HBsAg у некоторых людей, слишком рано делать осмысленные выводы об этой конечной точке», - сказал Лалезари в пресс-релизе конференции . «Ускоренное снижение и значительная потеря базовой РНК и виремии ДНК позволяют предположить, что комбинированная терапия с основным ингибитором плюс [нуклеозид / нуклеотидные аналоги] может усилить потерю cccDNA и вирусного антигена после того, как остаточная виремия будет полностью очищена».
Несмотря на эти многообещающие результаты, Ассамблея, по сообщениям, решила не продолжать разработку ABI-H0731 в пользу более мощных ингибиторов белка ядра, включая ABI-H2158 и ABI-H3733. В последнем плакате на конференции сообщалось, что ABI-H2158 хорошо переносился и продемонстрировал благоприятную фармакокинетику в исследовании фазы Ia; в настоящее время проводится исследование по выявлению дозы в фазе Ib . По сообщению компании, ABI-H3733, как ожидается, начнет исследования фазы Ia в начале следующего года.
Ф-0/ гепВ/АЛТ 40/нагрука 2000 МЕ/
- Nessi
- Бывалый
- Сообщения: 1116
- Зарегистрирован: 15 апр 2014 21:56
- Пол: ♀
- Гепатит: C
- Фиброз: F1
- Генотип: 1
- Город: Non
- Благодарил (а): 30 раз
- Поблагодарили: 296 раз
ILC - 2019 - конференция EASL
зашла в тему - все изображения недоступны
ссылки рабочие - проверила
спасибо, картинки стали появляться
Последний раз редактировалось Nessi 28 апр 2019 22:55, всего редактировалось 3 раза.
- Nessi
- Бывалый
- Сообщения: 1116
- Зарегистрирован: 15 апр 2014 21:56
- Пол: ♀
- Гепатит: C
- Фиброз: F1
- Генотип: 1
- Город: Non
- Благодарил (а): 30 раз
- Поблагодарили: 296 раз
ILC - 2019 - конференция EASL
А между тем вывешены Best of ILC 2019 slide decks - презентации с лучшими слайдами конференции.
https://ilc-congress.eu/slide-decks/#best-of-ILC
Интересующиеся могут скачать самостоятельно.
Да, в презентациях часто очень удобно: в заметках к слайдам приведены сами абстракты, то есть искать ничего не нужно.
https://ilc-congress.eu/slide-decks/#best-of-ILC
Интересующиеся могут скачать самостоятельно.
Да, в презентациях часто очень удобно: в заметках к слайдам приведены сами абстракты, то есть искать ничего не нужно.
- Gudvin
- ✔Добрый админ
- Сообщения: 28781
- Зарегистрирован: 24 фев 2009 23:05
- Пол: ♂
- Гепатит: С ушел в минус
- Фиброз: F2
- Генотип: 1
- Город: Million roses city
- Благодарил (а): 1580 раз
- Поблагодарили: 5554 раза