Гепатит дельта – 2019. Часть II: современное лечение и его перспективы*
ОБЗОРЫ
Гепатит дельта – 2019. Часть II: современное лечение и его перспективы*
Б.Н. Левитан
А.В. Дедов
Астраханский государственный медицинский университет
Адрес для переписки: Болеслав Наумович Левитан,
bolev@mail.ru
Для цитирования: Левитан Б.Н., Дедов А.В. Гепатит дельта – 2019. Часть II: современное лечение и его перспективы // Эффективная фармакотерапия. 2019. Т. 15. № 28. С. 76–82.
DOI 10.33978/2307-3586-2019-15-28-76-82
Эффективная фармакотерапия. 2019.Том 15. № 28. Гастроэнтерология
АннотацияСтатьяСсылкиАнглийский вариантКомментарии
Среди примерно полумиллиарда лиц, инфицированных вирусом гепатита B, насчитывается около 25 млн инфицированных вирусом гепатита D. Дельта-вирус часто вызывает более тяжелые, быстро прогрессирующие поражения печени. Лечение дельта-вирусной инфекции остается нерешенной проблемой. Более 30 лет используются препараты интерферона. В настоящее время широкое распространение получил пегилированный интерферон альфа. Но применение препаратов интерферона не гарантирует излечения у большинства больных дельта-инфекцией, не обеспечивает стабильной элиминации вируса и дает множество побочных эффектов. Новые препараты с иным механизмом действия – аналоги нуклеотидов и препараты со специфическими механизмами действия мирклудекс B (myrcludex B), лонафарниб (lonafarnib), REP 2139 проходят клинические испытания. Перспективной представляется комбинированная терапия пегилированными интерферонами и аналогами нуклеотидов.
Лечение гепатита D
Успешная терапия хронической инфекции, вызванной вирусом гепатита D (Hepatitis D virus, HDV), должна приводить к эрадикации как HDV, так и его «помощника» – вируса гепатита B (Hepatitis B virus, HBV). В 2017 г. Европейской ассоциацией по изучению болезней печени (European Association for the Study of the Liver, EASL) было издано Клиническое руководство по ведению пациентов с инфекцией, вызванной гепатитом B, в котором предусмотрен раздел по лечению больных с коинфекцией HDV [1].
Согласно рекомендациям EASL 2017 г., терапией выбора у пациентов с коинфекцией HDV/HBV с хроническим гепатитом (ХГ) или компенсированным циррозом печени (ЦП) является пегилированный интерферон альфа (пегИФН-альфа) в течение 48 недель (уровень доказательности I, степень клинической рекомендации 1).
Больным с коинфекцией HDV/HBV с продолжающейся репликацией ДНК HBV необходимо назначать аналоги нуклеотидов (уровень доказательности II-2, степень клинической рекомендации 1).
При хорошей переносимости лечение пегИФН-альфа может быть продолжено до 48 недель независимо от ответа на него (уровень доказательности II-2, степень клинической рекомендации 2).
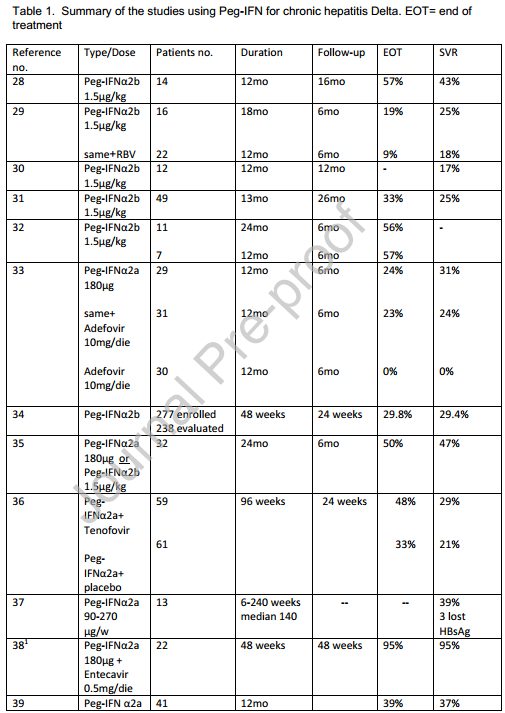
На сегодняшний день пегИФН-альфа – единственный доступный противовирусный препарат для лечения пациентов с хронической HDV-инфекцией с доказанной эффективностью. При использовании пегИФН-альфа вирусологический ответ на терапию достигается в 17–47% случаев [2].
По данным ряда исследований, у 25% пациентов концентрация РНК-HDV снижается на 24-й неделе применения пегИФН-альфа. Тем не менее поздние рецидивы после прекращения терапии отмечаются в 50% случаев, что позволяет подвергать сомнению возможность достижения устойчивого вирусологического ответа при коинфекции HDV/HBV. В связи с этим рекомендуется долгосрочное наблюдение за концентрацией РНК-HDV у всех получающих лечение пациентов – до тех пор, пока HBsAg определяется в сыворотке крови. Элиминация HBsAg возможна при длительном наблюдении примерно у 10% больных, находящихся на терапии пегИФН-альфа, что может служить маркером излечения HDV-инфекции [3, 4].
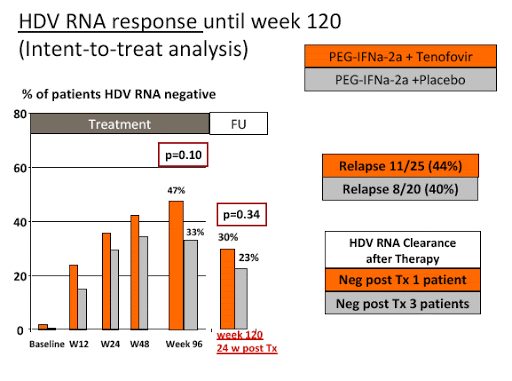
Были предприняты попытки повысить эффективность интерферонотерапии за счет увеличения ее длительности. Однако в настоящее время отсутствуют четкие доказательства, что подобная тактика подходит для большинства пациентов, хронически инфицированных HDV. При 96-недельной терапии пегИФН-альфа (монотерапия или в сочетании с тенофовиром) на 24-й неделе наблюдались рецидивы у 36,4% пациентов, ответивших на лечение [5].
Вероятность долгосрочного ответа на терапию пегИФН-альфа может быть оценена по уровням РНК-HDV и HBsAg на 12-й и 24-й неделе лечения. Преждевременное прекращение приема пегИФН-альфа не рекомендуется, если препарат переносится хорошо. Дело в том, что отрицательное прогностическое значение упомянутых маркеров невелико, а поздний ответ может возникнуть у больных с отсутствием раннего ответа на лечение. Предполагается, что терапия ИФН-альфа является фактором, приостанавливающим прогрессирование заболевания [6–9].
Ни аналоги нуклеотидов, ни рибавирин практически не влияют на уровень РНК-HDV у пациентов с HDV-инфекцией. Несмотря на то что HDV нередко доминирует, при естественном течении хронической HDV/HBV-инфекции можно наблюдать выраженные колебания концентрации обоих вирусов. Терапия аналогами нуклеотидов рекомендуется больным с уровнем ДНК-HBV выше 2000 МЕ/мл. Пациентам с декомпенсированным ЦП целесообразно назначать блокаторы репликации HBV, а не пегИФН-альфа. Такие больные должны пройти подготовку к трансплантации печени. Терапия аналогами нуклеотидов рекомендуется всем пациентам с декомпенсированным ЦП с определяемым уровнем ДНК-HBV [10, 11].
Современные рекомендации по применению интерферона альфа
Терапию ИФН-альфа могут получать только пациенты с компенсированным HDV-ассоциированным заболеванием печени. Единственным на сегодняшний день методом лечения декомпенсированного заболевания печени является трансплантация. ПегИФН-альфа – средство первого выбора при ХГ D. Годичный курс следует назначать всем больным, не получавшим ранее ИФН-альфа, а также тем, кто не ответил ранее на стандартную терапию ИФН-альфа. Сывороточные уровни РНК-HDV и HBsAg дают возможность клиницистам оценить ранний ответ, а также выявить больных с отсроченным вирусологическим ответом, которым может помочь длительная терапия [1, 2, 12].
Перспективы лечения хронического гепатита D
Эффективность терапии пегИФН-альфа как в монорежиме, так и в сочетании с аналогами нуклеотидов достаточно низкая, по окончании терапии часто возникают рецидивы. Поэтому крайне актуальна разработка новых видов терапии ХГ D.
Как показали результаты длительного проспективного исследования, рецидивы чаще возникают у «ответчиков» по сравнению с теми, у кого HBsAg исчез. Новые виды лечения необходимы больным с суб- и декомпенсированным ЦП, которым ИФН-альфа противопоказан.
В настоящее время клинические испытания проходят три класса новых лекарственных препаратов, влияющих на жизненный цикл HDV: ингибиторы его клеточного рецептора Na+-таурохолат ко-транспортного полипептида (NTCP), ингибиторы фарнезилтрансферазы (FTIs) и полимеры нуклеиновых кислот (NAPs).
Мирклудекс B: ингибитор проникновения вируса гепатита D в клетку
Проникновение вируса в гепатоциты – первый этап жизненного цикла HBV и HDV. При этом NTCP, ведущий переносчик желчных кислот (ЖК) в печени, был идентифицирован как рецептор для вхождения HBV и HDV в клетку. Мирклудекс B, соединение липопротеида и миристоленовой кислоты с 47 аминокислотными остатками, соответствующими pre-S1 N-терминальному сегменту L-HBsAg, ингибирует проникновение HBV и HDV за счет конкурентного ингибирования связывания с рецепторами. Как было показано на трансгенных мышах, этот препарат вмешивается в образование внутрипеченочных ковалентно сшитых циркулярных ДНК – HBV (cccDNA), предотвращая внутрипеченочное распространение вируса. В эксперименте на мышах с отсутствием гена NTCP D. Slijepcevic и соавт. подтвердили «печеночную» специфичность данного вещества в отношении NTCP [13–16].
Клинические исследования
Впервые безопасность мирклудекса B для человека оценили A. Blank и соавт. В исследовании 36 здоровых добровольцев получали лекарственное средство либо внутривенно, либо подкожно в возрастающих дозах вплоть до 20 мг/сут. Использование препарата сопровождалось повышением уровня конъюгированных ЖК. Этот уровень на фоне длительного применения не достигал опасных для пациента значений. Концентрация мирклудекса B, необходимая для блокирования проникновения вирусов HBV/HDV через NTCP-рецептор, была приблизительно в 100 раз меньше, чем та, которая нарушала транспорт ЖК. Это указывало на возможность блокирования вирусов без избыточной нагрузки в отношении транспорта ЖК. Пациенты хорошо переносили лекарственное средство. Только в двух случаях отмечались серьезные побочные эффекты – повышение уровней липазы и амилазы. Данное исследование стало предварительным в отношении тестирования мирклудекса B у больных гепатитом B или D [17, 18].
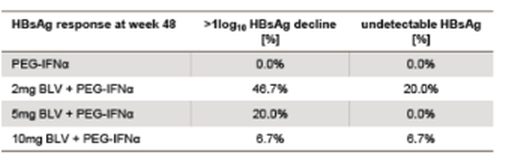
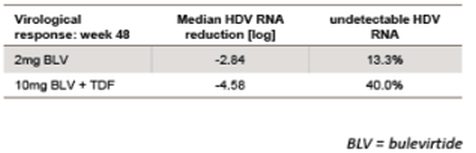
Безопасность и эффективность мирклудекса B при ХГ D изучали в пилотном российском исследовании. 24 пациента были разделены на три группы поровну (рандомизация). Пациенты первой группы получали мирклудекс B 2 мг/сут в течение 24 недель после 48-недельной терапии пегИФН-альфа-2а, пациенты второй – мирклудекс B совместно с пегИФН-альфа-2а в течение 24 недель, затем монотерапию пегИФН-альфа-2a еще 24 недели. Пациентам третьей группы назначали только пегИФН-альфа-2a в течение 48 недель. Первой конечной точкой служил ответ HBsAg, определяемый как снижение сывороточной концентрации HBsAg не менее чем на 0,5 log IU/мл. Все пациенты были негативными по HBeAg, у троих имел место ЦП, девять больных ранее получали пегИФН-альфа-2a. Исходно средняя сывороточная концентрация РНК-HDV составила примерно 104 копий/мл, а средняя концентрация HBsAg около 104 IU/мл. Промежуточный анализ на 24-й неделе исследования у пациентов, получавших только мирклудекс B, показал нормализацию уровня аланинаминотрансферазы (АЛТ) в шести случаях и снижение уровня РНК-HDV более чем в 10 раз (1 log) – в четырех, с клиренсом 2. Однако уровень HBsAg оставался неизменным у всех больных. После прекращения лечения РНК-HDV вновь обнаруживалась у всех пациентов. У пятерых больных из тех, кто получал мирклудекс B вместе с пегИФН-альфа-2a, РНК-HDV стала негативной. ДНК-HBV также значимо снизилась только в этой группе. Побочными эффектами мирклудекса B были тромбоцитопения, лимфопения, эозинопения, нейтропения. Причем все изменения были незначительно выраженными, преходящими и не требовали изменения дозы препарата. Антитела к исследуемому препарату выявлены у шести пациентов, получавших комбинированное лечение с пегИФН-альфа-2a. Несмотря на то что это не влияло на эффективность лечения, ученые проанализировали значение данных антител. Во всех группах, в которых применяли мирклудекс B, уровень ЖК, конъюгированных с таурином и глицином, повышался [19].
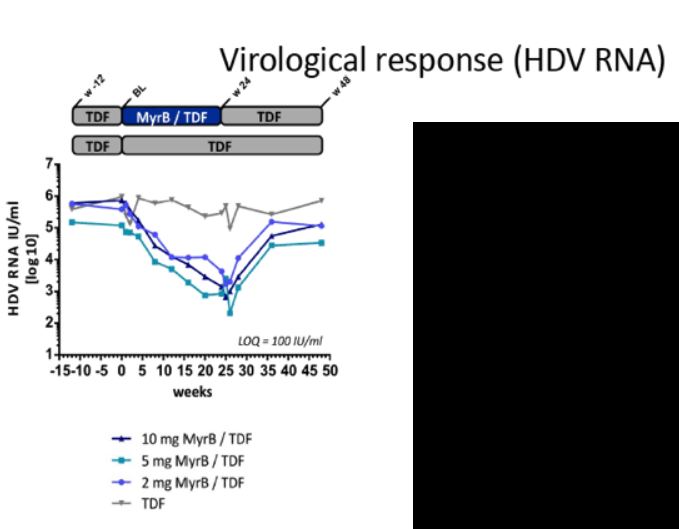
Недавно в виде резюме были представлены результаты фазы IIв многоцентрового открытого исследования. 120 больных гепатитом D, разделенных на четыре группы, получали мирклудекс B 2, 5 или 10 мг/сут в течение 24 недель в комбинации с тенофовиром и только тенофовир соответственно. Тенофовир назначали на 24-й неделе по окончании применения мирклудекса B. Первой конечной точкой служило снижение РНК-HDV на 2 log или до полного исчезновения. По завершении терапии медиана концентрации РНК-HDV снизилась на 1,75, 1,60 и 2,70 log в группах пациентов, получавших от низких до высоких доз мирклудекса B соответственно, и лишь на 0,18 log при использовании только тенофовира. Уровень АЛТ нормализовался у 42,8, 50,0, 40,0 и 6,6% пациентов соответственно. При 12-недельном исследовании РНК-HDV определялась лишь у 41 больного. Повторное появление РНК-HDV наблюдалось у 60, 80 и 83% «ответчиков» HDV, получавших мирклудекс B, и сопровождалось умеренным повышением уровня АЛТ. Предварительные данные, свидетельствующие о транзиторном эффекте мирклудекса B при ХГ D, позволяют предположить, что пациентам с этим заболеванием может потребоваться более длительное лечение [20].
Таким образом, мирклудекс B вызывает значительное снижение уровня РНК-HDV. Но этот эффект нестойкий, по окончании терапии не сохраняется. Результаты лечения были выше у больных, получавших одновременно мирклудекс B и пегИФН-альфа-2a. Монотерапия препаратом мирклудекс B при ХГ D малоэффективна. Уровни HBsAg не менялись при использовании мирклудекса B. Авторы предположили, что HBsAg может продуцироваться интегрированной в геном ДНК-HBV, отличной от cccDNA, и HBsAg снижается независимым от кинетики ДНК-HBV образом. Эффекты длительной монотерапии мирклудексом B или комбинированной терапии с пегИФН-альфа-2a и тенофовиром, а также использование более высоких доз должны быть изучены в дальнейших исследованиях [20].
Ингибитор сборки вируса лонафарниб и препарат REP 2139
Антигеномная цепь РНК-HDV, кодирующая S-HDAg, редактируется клеточным ферментом ADAR1, модифицирующим «янтарный» терминальный кодон S-HDAg. Это редактирование посттранскрипционной РНК приводит к выработке L-HDAg, который подвергается фарнезилированию, важнейшей модификации, связывающей РНК-HDV и HBsAg при сборке инфекционных частиц HDV. Таким образом, ингибиторы фарнезилирования (FTI) нарушают сборку вириона HDV и высвобождение вирусных частиц из инфицированных гепатоцитов, что показано как in vitro, так и in vivo на мышиной модели, когда два ингибитора фарнезилирования (FTI-277 и FTI-2153) проявили эффективность в ликвидации виремии HDV [21, 22].
Блокада процесса фарнезилирования с помощью FTI способствует накоплению промежуточных продуктов репликации HDV внутри гепатоцитов. Снижение концентрации сывороточной РНК-HDV происходит не за счет уменьшения количества инфицированных гепатоцитов, а в большей степени за счет снижения сборки частиц вируса HDV. Механизм, с помощью которого FTI уменьшает концентрацию сывороточной РНК-HDV, еще предстоит установить, а эффект внутриклеточного накопления частиц РНК остается малоизученным. Вопрос, может ли накопление репликативных интермедиатов HDV в печеночных клетках индуцировать цитотоксический эффект или усиливать иммуноопосредованное уничтожение клеток, остается нерешенным [23].
Лонафарниб, один из FTI, был изначально предложен как противораковое средство, поскольку фарнезилтрансфераза является важным клеточным ферментом, вовлеченным в некоторые клеточные функции, в том числе фарнезилирование ряда цитоплазматических белков семейства RAS, участвующих в росте, дифференцировке и выживании клеток, а также в Т-клеточной активации и выработке цитокинов [24, 25].
Хотя противоопухолевый эффект этого препарата не подтвержден, исследования в области онкологии предоставили важную информацию о его безопасности. Показано, что препарат вызывает побочные эффекты в основном со стороны желудочно-кишечного тракта. В краткосрочном плацебоконтролируемом исследовании 14 HBeAg-негативных пациента (две группы по семь больных), инфицированных HDV генотипа 1, получали лонафарниб перорально 28 дней (первая группа по 100, вторая – по 200 мг два раза в день) с последующим шестимесячным наблюдением. К концу терапии концентрация РНК-HDV значительно снизилась по сравнению с исходным уровнем (на 0,73 и 1,54 log в первой и второй группе соответственно). В группе плацебо этот показатель составил 0,13 log. Снижение РНК-HDV коррелировало с концентрацией лекарственного средства. Сывороточные уровни АЛТ и HBsAg не изменились, тогда как уровень РНК-HDV после прекращения терапии вернулся к исходным значениям у всех леченых пациентов. Вирусологический рецидив репликации РНК-HDV, превысивший исходный более чем на 0,5 log, наблюдался у пяти пациентов между 4-й и 8-й неделями лечения. В период вирусного «скачка» повышение уровня АЛТ составило не более чем 2,5 раза по сравнению с исходными параметрами. Кроме того, лекарственное средство не очень хорошо переносилось. У всех пациентов, получавших его в высоких дозах, отмечались тошнота, диарея, вздутие живота и потеря веса в среднем на 4 кг [26].
15 участников исследования LOWR HDV-1 (лонафарниб с добавлением ритонавира и без него для лечения HDV-инфекции) были разделены поровну на пять групп для определения оптимальной дозы препарата. Лонафарниб назначали в дозах 200 и 300 мг дважды в день или 100 мг трижды в день как в монорежиме, так и в сочетании с ритонавиром или пегИФН-альфа от восьми до 12 недель. Поскольку ритонавир является ингибитором цитохрома P450-3A4 – главного метаболизатора лонафарниба, предполагалось, что эта комбинация обеспечит максимальный внутрипеченочный уровень препарата. После четырех недель лечения HDV-виремия значительно уменьшилась независимо от схемы назначения лонафарниба – в монорежиме или в комбинации с другими препаратами. Это сочеталось со значительным снижением уровня АЛТ, однако отсутствовали изменения содержания HBsAg. Добавление ритонавира 100 мг к лонафарнибу 100 мг два раза в день вызывало более значительный антивирусный эффект и меньшее количество гастроинтестинальных побочных эффектов. Но в этой комбинации показатели HBsAg также не менялись. К концу лечения уровни сывороточных РНК-НDV и АЛТ возвращались к исходным параметрам у всех пациентов, за исключением двух. Пять пациентов, которые получали лонафарниб в дозах 200 и 300 мг дважды в день с пегИФН-альфа, прервали лечение в течение четырех недель из-за непереносимости [27].
Три других исследования под тем же акронимом (LOWR HDV-2, -3, -4) продолжаются, но предварительные результаты опубликованы в виде тезисов. В исследовании LOWR HDV-2, посвященном оценке наименьшей эффективной дозы лонафарниба в комбинированной терапии, 48 пациентов получали небольшие дозы препарата (75, 50 или 25 мг дважды в день) в комбинации с ритонавиром и пегИФН-альфа или без пегИФН-альфа. Тройной режим с лонафарнибом 25 или 50 мг, ритонавиром 100 мг дважды в день в комбинации с пегИФН-альфа 180 мкг показал лучший результат и переносимость [28].
В исследовании LOWR HDV-3 21 больной получал однократные ежедневные дозы лонафарниба (50, 75 или 100 мг) с ритонавиром 100 мг в течение 12 или 24 недель. Пациентам проводилась анти-HBV-терапия аналогами нуклеозидов до назначения лонафарниба. После 12 недель лечения средний log снижения концентрации РНК-HDV от исходного уровня колебался от 0,83 IU/мл (для лонафарниба 100 мг) до 1,6 IU/мл (для лонафарниба 50 мг). Комбинация ритонавира и лонафарниба у больных, получавших лечение в течение шести месяцев, была безопасной и эффективной в отношении снижения виремии HDV [29].
Увеличение дозы и достижение толерантности оценивали в исследовании LOWR HDV-4 с участием 15 пациентов. На старте терапии все больные получали лонафарниб в дозе 50 мг одновременно с ритонавиром 100 мг. Далее доза лонафарниба была увеличена до 75 мг, затем до 100 мг. Ритонавир назначали в дозе 100 мг дважды в день. В конце лечения снижение концентрации сывороточной РНК-HDV от исходного уровня составило 1,58 ± 1,38 log10 IU/мл. Уровни АЛТ нормализовались у 53% больных. Снижение РНК-HDV и нормализация уровня АЛТ не сохранялись после прекращения терапии. Кроме того, лонафарниб не оказывал существенного влияния на уровни HBsAg как до, так и после лечения. Возникновения резистентных мутаций не зафиксировано [30].
Значимость накопления рибонуклеопротеидного комплекса в гепатоцитах обусловливает перспективы длительного применения лонафарниба у больных ЦП. Более того, фарнезилтрансфераза является важным клеточным ферментом, что существенно для полного установления влияния его ингибирования на разнообразные внутриклеточные процессы.
REP 2139: полимер нуклеиновой кислоты
Фосфотионат фосфорилированных аналогов нуклеотидов (NAP) – это олигонуклеотиды с негативным зарядом и широкой ингибиторной активностью в отношении ряда вирусов (например, ВИЧ, вирус простого герпеса, вирус лимфоцитарного хориоменингита). Однако на модели НBV-инфекции на утках показано, что NAPs влияют как на проникновение вируса в клетку, так и на синтез и высвобождение HBsAg из гепатоцитов. Основываясь на этих результатах, безопасность и эффективность REP 2055 (Replicor) и REP 2139 (Replic) oценивали в первом, основанном на принципах доказательной медицины, исследовании у HBV-инфицированных HBeAg-позитивных больных. В обоих исследованиях на фоне монотерапии NAP наблюдалось уменьшение концентрации сывороточного HBsAg и ДНК-HBV с 2 до 7 и с 3 до 9 log соответственно, что сопровождалось появлением сывороточных анти-HBs (10–1712 мIU/мл). Из побочных эффектов лечения наблюдались лихорадка, головная боль и озноб [31–34].
Основываясь на значительном эффекте на сывороточный HBsAg, ученые изучили безопасность и эффективность REP 2139 в комбинации с пегИФН-альфа при ХГ D. В молдавском исследовании принимали участие 12 ранее не леченных больных в возрасте от 18 до 55 лет, позитивных по анти-HBeAg-антителам, а также по РНК-HDV с концентрацией сывороточного HBsAg свыше 1000 IU/мл и низким уровнем ДНК-HBV (от < 10 до 726 IU/мл). Ни у одного из пациентов не было ЦП. Больные получали REP 2139 500 мг внутривенно раз в неделю в течение 15 недель, далее комбинированную терапию REP 2139 250 мг и пегИФН-альфа-2a 180 мкг в течение 15 недель, затем монотерапию пегИФН-альфа-2a 180 мкг 33 недели. После лечения больные находились под наблюдением в течение года. На фоне монотерапии REP 2139 виремия HDV быстро снизилась у всех пациентов, 11 стали полностью РНК-HDV-негативными. Девять из них оставались негативными к концу лечения, а семь – после года наблюдения. У шести больных к концу лечения уровень HBsAg был менее 50 IU/мл. У пяти больных он оставался стабильным спустя год после окончания лечения. Кроме того, содержание анти-HBs-антител выше 10 IU/мл в конце лечения наблюдалось у шести больных и сохранялось у пяти пациентов к концу года наблюдения. Сывороточная ДНК-HBV исчезла к концу лечения у девяти пациентов и сохранялась на уровне менее 10 IU/мл у семи больных в течение всего периода наблюдения. Значительное повышение концентрации АЛТ наблюдалось после начала лечения пегИФН-альфа-2a у пяти (42%) пациентов, но это повышение было бессимптомным. Оно исчезло самостоятельно и не потребовало прекращения терапии. У всех больных имел место как минимум один побочный эффект: анемия, нейтропения или тромбоцитопения. Побочные эффекты у 33% больных относились преимущественно к пегИФН-альфа-2a.
О результатах, полученных в данном исследовании, не сообщалось, поскольку оно проводилось с участием незначительного количества пациентов. К концу первого года наблюдения комбинированная терапия REP 2139 с пегИФН-альфа-2a приводила к исчезновению HBsAg и РНК-HDV, появлению высоких титров анти-HBs, исчезновению ДНК-HBV у примерно 50% больных. Вероятно, REP 2139 подавляет образование HBsAg как из cccDNA, так и из интегрированной в геном клетки ДНК-HBV [35].
Несмотря на положительные результаты, остаются вопросы в отношении лечения NAP. Ни один из больных, включенных в исследование, не имел ЦП. Как известно, больные ХГ без ЦП лучше отвечают на терапию ИФН-альфа. Уровни АЛТ и аспартатаминотрансферазы увеличиваются во время лечения. Важно установить природу и значимость раннего появления высоких титров антител к HBsAg, поскольку они обычно обнаруживаются при лечении NAP. В конечном итоге молекулярные механизмы, лежащие в основе ингибирования высвобождения частиц HBsAg, до сих пор не известны. Как следствие, неясно, что влияет на внутриклеточное накопление HBsAg, которое способно приводить к повреждению печени и развитию гепатоцеллюлярной карциномы [36, 37].
Заключение
ИФН-альфа уже более 30 лет применяется у больных ХГ D. В схеме лечения дельта-инфекции он и сегодня остается основным в силу доказанной эффективности. Вместе с тем показано, что вирусологический ответ на фоне применения пегИФН-альфа наблюдается только в 25% случаев. В то же время, несмотря на относительно успешное подавление репликации нуклеиновых кислот HBV и HDV, влияние на HBsAg незначительно. Это требует разработки новых, более эффективных препаратов. Трудности их разработки и внедрения в медицинскую практику обусловлены отсутствием собственных ферментов у вируса HDV.
В последние годы на основе детального изучения функционирования вируса-помощника ДНК-HBV созданы три препарата мирклудекс B, лонафарниб и REP 2139, которые находятся в стадии клинических испытаний при ХГ D. Каждый препарат влияет на HDV, воздействуя на HBsAg.
К сожалению, данные литературы свидетельствуют, что эффективные анти-HDV-препараты отсутствуют. Исключение составляют пегилированные интерфероны, которые, однако, обеспечивают стойкий вирусологический ответ спустя год после терапии лишь в небольшом проценте случаев. Эффективность лечения оценивается по снижению уровней HDV и HBsAg, нормализации уровня АЛТ, уменьшению выраженности проявлений болезни, хотя полной эрадикации вируса пока не достигнуто.
Из сказанного следует, что необходимы дальнейшие исследования для оценки эффективности комбинированной терапии хронической HDV-инфекции имеющимися препаратами, а также создание новых эффективных лекарственных средств.
КЛЮЧЕВЫЕ СЛОВА: вирус гепатита, цирроз печени, противовирусная терапия, интерферон, аналоги нуклеотидов
 Подробнее
Подробнее