Я смотрю, тема "побочности" NUCs все так же актуальна.
Возможно, многим будет полезно,
Краткий ликбез по основным проблемам использования NUCs и переносимости:
Aliment Pharmacol Ther. 2018 Mar;47(6):730-737. doi: 10.1111/apt.14497. Epub 2018 Jan 22.
Review article: long-term safety of oral anti-viral treatment for chronic hepatitis B.
Wong GL, Seto WK, Wong VW, Yuen MF, Chan HL.
Нефротоксичность
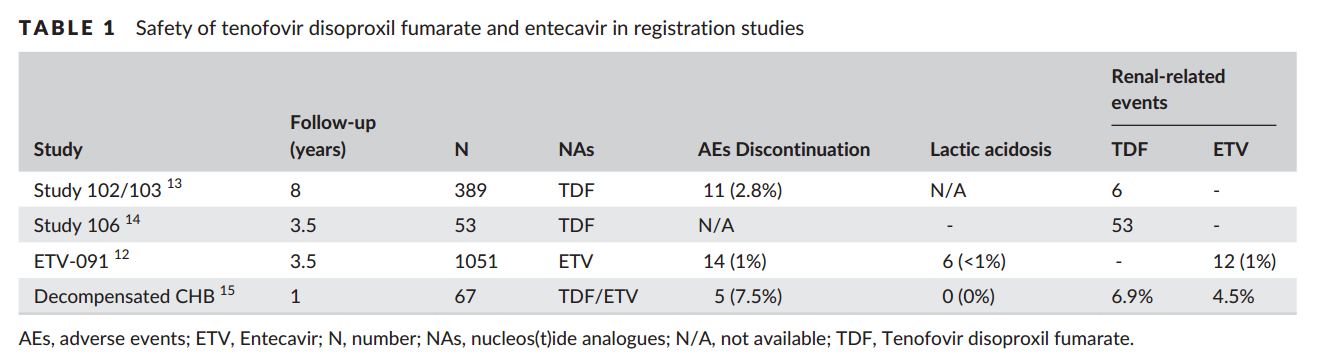
Известно, что хроническая инфекция HBV сама по себе увеличивает риск хронического заболевания почек (ХЗП), такого как мембранный гломерулонефрит.[18] С другой стороны, все NUCs выводятся из организма через почки. Старые поколения нуклеотидных аналогов, то есть адефовир и TDF, как известно, связаны с небольшим, но значительным риском нефротоксичности. Механизмы нуклеотидной анатомической нефротоксичности включают ингибирование накопления трубчатых клеток в эндогенных соединениях, что приводит к кратковременной токсичности; и митохондриальной токсичности в долгосрочной перспективе. Адефовир и тенофовир являются субстратами органического анион-транспортера (ОАТ) -1 и ОАТ-3; Адефовир и тенофовир активно транспортируются в MRP-4 в проксимальную трубочку; когда MRP-4 насыщен, адефовир и тенофовир могут накапливаться во внутриклеточной среде, что приводит к повреждению трубчатых клеток (рис. 1) .[19] Повышенный уровень креатинина в сыворотке ≥0,5 мг / дл был обнаружен у 3-4% среди пациентов, получавших адефовир в течении 5 лет, по сравнению с 0% в группе плацебо. [20] Так же повышения уровня креатинина в сыворотке наблюдалась у 1% пациентов, получавших TDF в течение 5 лет.[21] Была ли степень этих биохимических изменений отражена на долгосрочный клинический курс - неизвестно.

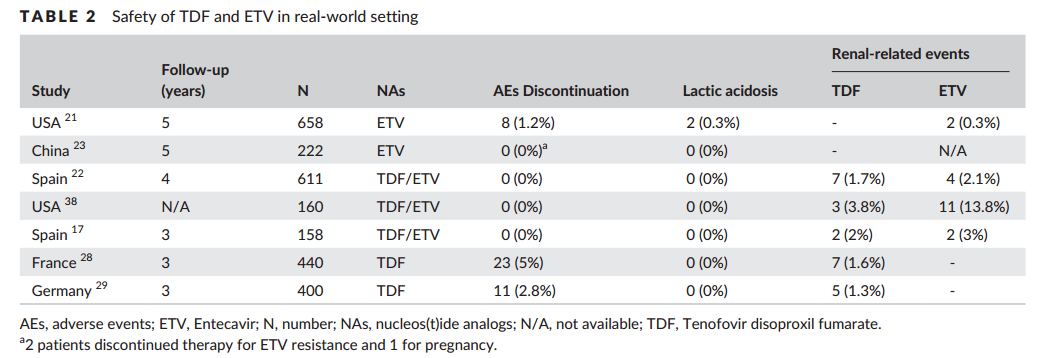
Широкомасштабное исследование 53 500 китайских пациентов с ХГВ показало, что лечение NUCs в целом не увеличивало риск тяжелых побочных явлений связанных с почками, включая почечную недостаточность и диализ (РРТ); эти события имели место у 1,4% и 0,7% соответственно у пациентов, получавших NUCs, при медианном наблюдении 5 лет [22]. Среди пациентов, получавших лечение на основе NUCs, риск почечных нежелательных событий был также одинаковым у пациентов, получавших NUCs и не получавших NUCs [22]. Благоприятный профиль безопасности подтвержден еще двумя исследованиями в реальной жизни, в которых участвовали кавказские пациенты с ХГБ в Европе и в США [23,24].
Вышеуказанные наблюдения предполагают, что при адекватном мониторинге функции почек в сочетании с надлежащей корректировкой дозировки или типа нуклеотидных аналогов позволяют продолжать лечение без увеличения клинически значимых почечных событий у пациентов с ХГБ. Это включает в себя своевременное обнаружение почечной недостаточности, чтобы доза могла быть соответствующим образом скорректирована или даже прекращена, если это необходимо. Другое недавнее исследование показало, что даже необработанные пациенты с ХГБ имеют значительный риск развития ХЗП; 5-летняя кумулятивная частота прогрессирования ХЗП составляла 48% при лечении TDF и 43% у пациентов, не получавших лечение [25]. Кроме того, частота заболеваемости была достоверной выше как у пациентов, получавших лечение на основе NUCs, так и у пациентов без лечения, чем у населения в целом.[26] Следовательно, регулярный мониторинг функции почек должен предлагаться не только пациентам, получающим лечение, но и необработанным пациентам с ХГБ. Это особенно важно у пациентов с хорошо распознанными факторами риска нефротоксичности, которые включают гипертонию, сахарный диабет, ранее существовавшие нарушения почек или использование сопутствующих нефротоксических агентов; (eGFR) уровни фосфата сыворотки должны регулярно контролироваться [27]. В недавнем европейском многоцентровом перспективном исследовании фосфат сыворотки, мочевая кислота, микрофлобулин альфа-1 мочи и глюкоза могут быть использованы для идентификации дискретной трубчатой патологии у пациентов, получающих терапию NUCs [28]. Интересное наблюдение, что телбивудин может улучшить показатель eGFR29 и предотвратить нефротоксичность у пациентов, получавших адефовир [30]. Было отмечено увеличение среднего значения eGFR на 8,5% в течение 6 лет, наблюдавшегося в исследовании GLOBE, в котором телбивудин получали на 2 год [31]. Тем не менее, не было убедительных клинических данных, указывающих на то, что телбивудин действительно снижает ХЗП и потребность в диализе;
Вопрос нефротоксичности TDF будет исчезать в ближайшем будущем так как новое поколение нуклеотидного аналога, TAF, был одобрен в большинстве странах мира. В последних руководящих принципах EASL для ХГВ рекомендуется использовать TAF как препарат первой линии; Было показано, что TAF предпочтительнее TDF, если у пациента есть/ или есть риск заболевания почек либо костной ткани [7]. При аналогичном подавлении вируса было показано, что TAF имеет лучший профиль безопасности касающийся почек и костей по сравнению с TDF [3,4]. На 96 неделе два исследования фазы 3 на 1298 пациентах, пациенты, получавшие TAF, имели меньший спад в eGFR ( 2,4 мл / мин), чем пациенты, получавшие TDF (6,7 мл / мин, P = 0,008) [33]. Пациентам, получающим TDF и подверженные риску развития и / или с наличием заболевания связанного с почками (или костной ткани), следует рассматривать переход на ETV или TAF в зависимости от предыдущего лечения на основе ламивудина [7].
Костная "токсичность"
Костная токсичность является еще одной серьезной проблемой. Дефицит витамина D (25-гидроксихолекальциферол в сыворотке <32 нг / мл) был обнаружен у 82% китайских пациентов с ХГБ [35]. В глобальное клиническое исследование, включающее 737 пациентов с ХГБ показало, что у 35% была недостаточность, а 58% имели дефицитные уровни витамина D [36]. Азиатские пациенты особенно подвержены риску развития костных проблем с учетом низкого индекса массы тела, низкой минеральной плотности костной ткани (МПК) и высокой распространенность остеопороза [37] Считается, что NUCs не имеют прямого эффекта на костную ткань; Тем не менее, их влияние на почечную функцию может быть связано с фосфатурией и потерей костной ткани (рис. 2) [38] Сообщается о снижении МПК и даже гипофосфатемической остеомаляции у пациентов, получающих лечение адефовиром или TDF, хотя последнее было зарегистрировано только у пациентов, получавших TDF при коинфекции вирусом иммунодефицита человека (ВИЧ) [39] В исследовании, проведенном в Гонконге, пациенты, получавшие NUCs, имели схожий риск перелома тазобедренного сустава, перелома позвонков и всех переломов по сравнению с необработанными пациентами с ХГБ [22]. Дальнейший подробный анализ показал, что все переломы случались только у пациентов, получавших адефовир, но не TDF; кроме того, абсолютная частота событий была низкой (0,7 на 1000 человеко-лет) [22] Подобно проблеме нефротоксичности, TAF уменьшит опасения по поводу костной токсичности. Объединенный анализ двух упомянутых выше исследований Фазы 3 показал, что у пациентов, получавших TAF, наблюдалось меньшее снижение МПК, особенно бедра (0,28%), чем у пациентов, получавших TDF (2,16%, P <0,001) [33] Значительно меньше пациентов в группе TAF, чем в группе TDF испытывали снижение костной массы на 3% в позвоночнике (25% против 45%) или бедра (14% против 39%) в течение 96 недель [40] Кроме того, у пациентов, которые переключались с TDF на TAF, улучшался костный профиль (а также почечный) [41]. TAF может быть более приемлемым NUCs у пациентов с ХГВ и факторами риска переломов и остеопороза.

Риски связанные с онкологией
Всегда были некоторые опасения по поводу влияния антивирусного лечения на риск развития рака, отличного от печени, поскольку энтекавир демонстрирует потенциальный канцерогенный эффект в некоторых ранних исследованиях на животных. Энтекавир, один из наиболее часто назначаемых нуклеозидных аналогов во всем мире, увеличивает вероятность развития аденомы и карциномы легких, гепатоцеллюлярную карциному (HCC) и сосудистые опухоли у мышей в дозе 4 мг / кг; в то время как дозы от 1,4 мг / кг до 2,6 мг / кг у крыс увеличивали развитие ГЦК, опухолей головного мозга и фибромы кожи [12] Эти супертерапевтические дозы энтекавира в этих исследованиях на животных были по меньшей мере в 100 раз выше, чем используется у людей. К счастью, не было выявлено риска развития рака у пациентов, получающих энтекавир долгосрочно. По данным популяционного исследования, проведенного на 44 494 пациентах в Гонконге, у пациентов, получавших лечение NUCs, были одинаковые риски различных распространенных злокачественных новообразований, в частности желудочно-кишечных, легких, мочевых и почечных злокачественных новообразований, по сравнению с необработанными пациентами (таблица 1) [42]. Поскольку развитию опухоли легких предшествовало распространение пневмоцитов в легких мышей, то же самое не происходило у других животных (крыс, собак и обезьян), канцерогенный эффект, скорее всего, специфичен для вида. Тем не менее, по-видимому, наблюдался незначительный повышенный риск колоректального рака и, возможно, рака шейки матки у женщин, получавших NUCs, что продемонстрировано в анализе подгруппы.[42] Абсолютное число колоректальных и цервикальных опухолей в группах, где пациенты получали NUCs, и в группе, без лечения составляло всего 5 и 2 случая из 1299 пациентов соответственно, что является незначительным увеличением. Для установления точных рисков развития колоректального рака и рака шейки матки у пациентов с NUCs потребуется больше данных. Врачи должны учитывать соответствующие факторы риска (например, семейный анамнез, сопутствующие заболевания) и решать необходимость своевременного скрининга колоректального и цервикального скрининга рака для женщин, получающих лечение на основе NUCs.

Митохондриональная токсичность
NUCs могут влиять на репликацию митохондриальной ДНК посредством ингибирования ДНК-полимеразы человека, что может привести к различным клиническим проявлениям митохондриальной токсичности, включая миопатию, периферическую невропатию и лактоацидоз [43] Такие симптомы митохондриальной токсичности были заметны при лечении ингибиторами обратной транскриптазы при терапии ВИЧ-инфекции, [44] и наблюдались также в раннем клиническом исследовании с участием фиалуридина против ХГВ [45]. Миопатия также часто наблюдалась в международном исследовании III фазы клевудина, что привело к ранней остановки исследований [10] В регистрационном исследовании телбивудина 7,1 % участников испытали увеличение креатинкиназы до более чем семикратного превышения нормы после 1 года лечения [46] В 4-летнем открытом исследовании 655 пациентов с ХГВ 71% участников испытали некоторую степень роста сывороточной креатинкиназа, хотя такие возвышения обычно были временными и обратимыми, без необходимости остановки телбивудина. Миалгия отмечена у 6,1%, из которых три пациента с клинической миопатией потребовали прекращения тельбивудина [47] Хотя клинически значительная миопатия при лечении тельбивудином по-прежнему необычна, поскольку не сообщается о случаях рабдомиолиза или миокардита [14], по-прежнему целесообразно контролировать креатинкиназу у таких пациентов и для мониторинга симптомов митохондриональной токсичности. В противном случае митохондриональная токсичность не является значимой особенностью среди применяемых в настоящее время типов NUCs [43].
Периферическая невропатия
Как и митохондриальная дисфункция, периферическая невропатия также была связана с антиретровирусной терапией ВИЧ [44], но обычно не наблюдается при лечении HBV-ассоциированными NUCs. Однако это может происходить во время комбинации телбивудина с пегилированным интерфероном. Рандомизированное исследование сравнивало эффективность и безопасность комбинированной терапии тельбивудином и пэгилированным интерфероном альфа-2а, монотерапией telbivudine и пегилированного интерферона в режиме монотерапим, при лечении HBeAg положительного ХГВ. Это исследование было прекращено досрочно, когда 14% из группы комбинации испытывали периферическую невропатию после медианной продолжительности лечения 3,3 месяца. Клиническое представление варьировалось от периферической сенсорной невропатии до демиелинизирующей полинейропатии, при этом пациенты демонстрировали улучшение симптомов после прекращения лечения [48] Периферическая невропатия в других случаях обычно не наблюдалась во время монотерапии telbivudine, [46,48], и ее появление было зарегистрировано лишь в единичных случаях среди других NUCs (ламивудин и энтекавир) [49,50] Хотя синергический механизм невропатии при сопутствующей терапии тельбивудином и пегилированным интерфероном остается неясным, совместное использование этих двух препаратов не рекомендуется.
Лактоацидоз
Возможное развитие потенциально фатального молочнокислого ацидоза - это предупреждение на всех NUCs, обозначенное на коробках, основанное на связи между лактоацидозом и антиретровирусной терапией ВИЧ [51]. Имелись спорадические сообщения о лактоацидозе, возникающем при лечении ВГВ. На основании опубликованных случаев, связанных с TDF [52,53] и энтекавиром, [15,54] почечная недостаточность, по-видимому, является важным фактором, вероятно, из-за митохондриональной токсичности, если корректировки дозы не были быстро проведены. Сообщаемые случаи, касающиеся энтекавира имели место при декомпенсированном заболевании печени, включая одного пациента, которому назначали энтекавир 1 мг в день изза перекрестной резистентности [15] Другие факторы, способствующие развитию, включают наличие тяжелого сепсиса [54] и прием иммунодепрессантов. Также сообщалось о лактическом ацидозе у пациентов, получавших терапию telbivudine [56] и adefovir [55]. С реального опыта, лактоацидоз во время лечения ВГВ, вероятно, является редким событием. Тем не менее требуется высокая степень клинической осведомленности о возможности его развития, особенно у пациентов с множественными сопутствующими заболеваниями, плохим почечным резервом и декомпенсацией печени; Известно, что фульминантное заболевание печени является установленным фактором риска развития лактоацидоза. Важное значение имеет осторожная и своевременная корректировка дозировки NUCs с учетом функции почек.
Безопасность при беременности и грудном вскармливании
HBV эндемичен во многих азиатских и африканских странах с высоким уровнем рождаемости [58], и поэтому любая потенциальная ассоциация NUCs с тератогенностью требует особого внимания. Показания к NUCs и особенно к TDF во время беременности также были расширены для профилактики передачи вируса от матери к плоду у пациентов с высоким риском (HBeAg-положительная и ДНК HBV> 200 000 МЕ / мл), о чем свидетельствует рандомизированное контролируемое сравнительное исследование. Безопасность различных NUCs в отношении беременности и грудного вскармливания представлена в таблице 2. TDF и telbivudine ранее были категоризированы FDA в группу B, в то же время как энтекавир, ламивудин и адефовир были включены в категорию C.
Обширные данные по безопасности можно найти из опыта антиретровирусного лечения, в регистре, который обеспечивает информацией о безопасности для более чем 100 000 новорожденных. Все шесть зарегистрированных NUCs, имеющих отношение к ВГВ, включены в реестр беременности, хотя на момент написания доклада только ТДФ и ламивудин имели адекватные индивидуальные данные для анализа [59]. Не было увеличения риска серьезных врожденных дефектов среди пациентов с TDF или ламивудином по сравнению с контрольными группами населения [60,61]. Систематический обзор также выявил, что TDF, телбивудин и ламивудин безопасны во время беременности без увеличения неблагоприятных материнских или фатальных исходов [62] Последние рекомендации Американской ассоциации по изучению заболеваний печени поддерживают использование TDF, telbivudine и ламивудина во время беременности [9], в то время как Европейская ассоциация рекомендует только TDF из-за его превосходной вирусологической эффективности [7]. Что касается грудного вскармливания, TDF минимально выводится с грудным молоком, а абсорбция через желудочно-кишечный тракт младенца пренебрежимо мал [61] Исследования, связанные с грудным вскармливанием ВИЧ-инфицированных матерей, показали, что TDF не влияет на рост младенцев до 2 лет, хотя долгосрочные исследования отсутствуют [63] Международные рекомендации, как правило, говорят о том, что грудное вскармливание не противопоказано во время терапии телбивудином, [7,9], но такие рекомендации не принимаются повсеместно [64]. На момент написания, данные о безопасности TAF во время беременности все еще не хватает. Учитывая его сниженную системную токсичность и превосходный профиль безопасности по сравнению с TDF, [3,4] TAF, по-видимому, должен быть подходящей альтернативой беременным пациентам. Как только такие данные появятся, TAF может быть идеальным NUCs для беременных женщин и кормящих матерей.

Догма о пожизненном приеме NUCs в скором времени может потерять свою актуальность в связи с:
● оптимизацией сроков этой самой терапии: значительная доля пациентов может рассчитывать на "безболезненную" остановку лечения через 4-5 лет после подавления вирусной ДНК.
● меньшая, но значимая доля пациентов, которая испытывает вирусологический и биохимический рецидивы после долгосрочного подавления ДНК может рассчитывать на "перестройку" иммунного ответа против HBV, а следовательно добиться иммунологического контроля (как минимум) и потери HBsAg (как максимум).
● перспективные анти-HBV разработки стремительно набирают обороты в последние годы, в обозримом будущем появятся препараты, которые будут способны обеспечить если не функциональный контроль HBV (HBsAg отриц.), то устойчивый иммунологический контроль репликации (т.е выход в состояние неактивного носительства).
Таким образом, необходимость пожизненной терапии NUCs, о которой Вы говорите, отпадет сама собой, у некоторых пациентов, по моему́ скромному мнению.
Не для кого не секрет, что терапия первой линии, в которую входят NUCs, является жизненной необходимостью для пациентов, испытывающих стойкую репликацию, нередко сопровождающуюся высокими уровнями АЛТ и нарастанием фиброза. Аналоги нуклеоз(т)идов эффективно снижают частоту долгосрочных осложнений, связанных с печенью и это является основополагающим моментом, а все остальное здесь вторично, по моему́ скромному мнению. Данные об отдаленных побочных эффектах NUCs в литературе, по видимому, отсутствуют (во всяком случае, я встречал только данные о 10-летнем наблюдении).
Возможно, причинами тому являются:
- их отсутствие либо клиническая значимость таковых не определена
- то, что современные, эффективные и безопасные NUCs (TDF, TAF, ETV) еще не имеют под собой столь внушительной базы для подобного рода анализа - именно в контексте монотерапии ВГВ
- вектор исследований сместился в сторону попыток остановки долгосрочного лечения или разработок перспективных методов лечения.
 Подробнее
Подробнее