Обзор по теме "Остановка длительного лечения аналогами нуклеоз(т)идами является благоприятным вариантом для отдельных пациентов с HBeAg-негативным хроническим гепатитом В."
*Я не стал ничего вырезать, перевёл полностью.*
Liver Int.
2018 Feb;38 Suppl 1:90-96. doi: 10.1111/liv.13654.
Stopping long-term treatment with nucleos(t)ide analogues is a favourable option for selected patients with HBeAg-negative chronic hepatitis B.
van Bömmel F, Berg T.
https://www.ncbi.nlm.nih.gov/pubmed/29427489
Иммунный ответ против инфекции нарушается у пациентов с хроническим гепатитом В, и хотя ДНК HBV может эффективно подавляться аналогами нуклеоз(т)идов (NA), прочный иммунный контроль устанавливается только у небольшого числа пациентов. Особенно это относится к HBeAg-отрицательным пациентам, которые обычно должны получать пожизненное лечение на основе NUCs. Остановка терапии NUCs приводит к рецидиву у большинства пациентов. Имеются некоторые данные о том, что эта внезапная реакция на вирусные антигены может вызвать иммунный контроль у некоторых пациентов, что в свою очередь может привести к потере HBsAg или к форме иммунного контроля, а затем и к поддержанию низких уровней ДНК HBV и нормальной аланинаминотрансферазы (ALT). В первом проспективном рандомизированном исследовании, посвященному прекращению лечения тенофовиром у пациентов с отрицательным HBeAg, большинству пациентов не потребовалось повторного лечение после прекращения курса NA, хотя у всех пациентов наблюдался кратковременный рецидив ДНК HBV. Потеря HBsAg была выявлена почти у 20% пациентов через 3 года после остановки лечения NA. Дальнейшее подтверждение этих результатов необходимо в более крупных рандомизированных исследованиях, и пациенты, которые, скорее всего, получат выгоду от конечной терапии, должны быть идентифицированы.
ВВЕДЕНИЕ
В отличие от пациентов с HBeAg-положительным хроническим гепатитом B, нет четко определенных конечных точек лечения для пациентов с HBeAg негативным ХГВ. Текущие руководящие принципы лечения рекомендуют долгосрочную терапию NUCs до тех пор, пока не будет установлен иммунологический контроль, который, как полагают, характеризуется клиренсом HBsAg. Иммунологический контроль и клиренс HBV-инфекции в значительной степени зависят от CD8 + T клеток. Серологические ответные маркеры иммунологического контроля включают потерю HBsAg, а также сероконверсию HBeAg у пациентов с положительным HBeAg. К сожалению, пациенты с ХГВ обычно демонстрируют неэффективные реакции CD8 + Т-клеток. Причиной этого так называемого истощения Т-клеток считается постоянная вирусная антигенимия, что постепенно приводит к потере противовирусных эффекторных функций Т-клеточного иммунитета. Потеря иммунологического контроля может быть причиной того, что скорость потери HBsAg при лечении NUCs крайне низка. Таким образом, потеря HBsAg наблюдалась у не более чем 10% пациентов с HBeAg-позитивным ХГВ и, что более разочаровывающе, менее чем у 1% пациентов с отрицательным HBeAg после 8 лет приема тенофовира. В результате, пациенты с HBeAg-негативным хроническим гепатитом В почти всегда нуждаются в пожизненном лечении NUCs.
Ключевые моменты:
• Серологический ответ на терапию NUCs редко встречается у пациентов с HBeAg-негативным ХГВ.
• Прекращение долгосрочного лечения NUCs может вызвать прочный иммунный контроль и потерю HBsAg у некоторых пациентов.
• Рецидивы ДНК HBV могут спровоцировать иммунный контроль, но серьезная биохимическая активность вызывает беспокойство.
• Для возобновления лечения пациентов после отмены NUCs необходимы соответствующие алгоритмы для определения необходимости его назначения.
• Потребность в маркерах, которые точно прогнозируют, какие пациенты могут извлечь выгоду из прекращения терапии, для разработки индивидуализированных стратегий прекращения лечения.
КОНЦЕПЦИЯ ОСТАНОВКИ ТЕРАПИИ У HBeAg-ОТРИЦАТЕЛЬНЫХ ПАЦИЕНТОВ:
В 2006 году Hadziyannis и соавторы опубликовали небольшое неконтролируемое одноцентровое исследование. 33 пациента с HBeAg-отрицательной хронической инфекцией HBV, которые прекратили 3-5 летнее лечение адефовиром. Важной деталью этого отчета было то, что, хотя все пациенты первоначально демонстрировали рецидив ДНК HBV, а большинство из них - последующий биохимический рецидив, через 69 месяцев 18 пациентов (55%) достигли иммунологического контроля инфекции HBV и получили устойчивую биохимическую и вирусологическую ремиссию. Но наиболее поразительно, что HBsAg клиренс произошел во время длительного наблюдения у 39% этих пациентов, не получавших никакого дальнейшего лечение. Механизм, ведущий к иммунологическому контролю у этих пациентов не был до конца понятен. Тем не менее, продолжаются дискуссии о том, может ли долгосрочное подавление ДНК HBV в конечном итоге активизировать истощенные CD8 + Т-клетки и восстановить иммунный контроль. Прекращение лечения NUCs и последующее внезапное увеличение ДНК HBV и HBV-белков также могут быть важным триггером для повторного индуцирования ответов Т-клеток против HBV-инфицированных гепатоцитов (рис. 1). В недавно опубликованном небольшом исследовании несколько плазменных цитокинов, хемокины и факторы роста, указывающие на активность Т-клеток, анализировали в сыворотке HBeAg-отрицательных пациентов, у которых лечение NA было остановлено. Цитокины, которые увеличивались после отмены NA, включали интерлейкин 12, который, как было показано, важен для индукции и восстановления адаптивных ответов Т-клеток.
Рис 1:
 ОТНОСИТЕЛЬНАЯ ДОКАЗАТЕЛЬНОСТЬ ?
ОТНОСИТЕЛЬНАЯ ДОКАЗАТЕЛЬНОСТЬ ?
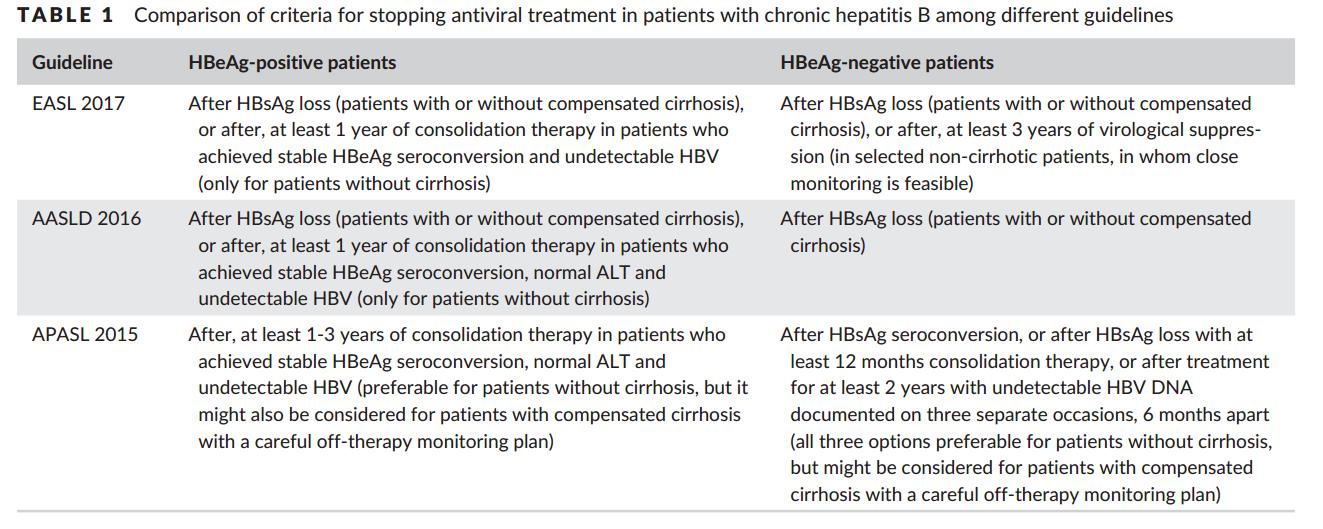
Дизайн исследования Hadziyannis, прежде всего, небольшое количество включенных в него пациентов оставляли много вопросов о достоверности этих результатов, а также о определении иммунного контроля, который выражается низким уровнем ДНК HBV в отсутствие серологического ответа. Однако высокий уровень ответчиков у пациентов с отрицательным HBeAg был очень важен для многих и привел к дальнейшим исследованиям по оценке ответа после лечения NUCs. Таким образом, были опубликованы многочисленные, в основном не рандомизированные исследования, оценивающие ответ после прекращения лечения NA. Большинство из этих исследований представляли собой ретроспективные анализы после ограниченной продолжительности лечения NUCs. Недавний метаанализ был проведен по результатам наблюдений после остановки NA-терапии у 1716 пациентов в 25 исследованиях, 733 (42,7%) HBeAg-положительных и 967 (56,4%) HBeAg-негативных, преимущественно азиатской популяции. Цирроз на исходном уровне был у 243 (17,8%) из 1362 пациентов с зарегистрированными признаками гистологической патологии. Используемые NA включали в себя: ламивудин, адефовир, энтекавир и телбивудин. Хотя во многих из этих исследований ответ на остановку терапии NUCs определялся по-разному, он всегда включали в себя низкие уровни ДНК HBV (в большинстве исследований ниже <2000 МЕ / мл) и нормальные или близкие к нормальным уровням аланинаминотрансферазы (ALT). Результаты показали, что через 12, 24 и 36 месяцев после отмены NUCs, 51,4%, 39,3% и 38,2% пациентов были ответчиками соответственно. Общая суммарная частота долговременного ответа была выше у пациентов, которые были HBeAg-положительными (50,6%), чем e HBeAg-негативных (38,0%) пациентов. 88% пациентов, которые достигли потери HBeAg во время лечения NA, сохраняли необнаруживаемый HBeAg и через 36 месяцев после отмены NA. Клиренс HBsAg был обнаружен у 2% пациентов с аналогичными показателями у пациентов с HBeAg-положительным и HBeAg-отрицательным ХГВ. Существует очень мало проспективных исследований, оценивающих результат после лечения NA у HBeAg-отрицательных пациентов (таблица 1). В этих исследованиях конечной точкой был рецидив ДНК HBV после прекращения лечения NUCs, а их частота составляла 45-49% (рисунок 2). После лечения уровень HBsAg снизился на 8-20%. Авторы двух исследований оценили устойчиво низкий уровень ДНК HBV после прекращения терапии NA в качестве конечной точки и обнаружили, что 8,4% и 33% пациентов поддерживали ДНК HBV ≤ 2000 МЕ / мл год после лечения.
Хотя результаты этих исследований отличаются и в некоторых отношениях даже противоречивы, они предполагают, что некоторые отрицательные HBeAg пациенты получат устойчивую вирусологическую ремиссию после отмены NA и что некоторые из них могут даже добиться потери HBsAg. Тем не менее, проекты этих исследований и включенных в них пациентов чрезвычайно неоднородны, что делает невозможным составление четкого заключения.
Таблица 1:
 Рисунок 2:
Рисунок 2:
 НАШЕ ПЕРВОЕ ПРОСПЕКТИВНОЕ ИССЛЕДОВАНИЕ
НАШЕ ПЕРВОЕ ПРОСПЕКТИВНОЕ ИССЛЕДОВАНИЕ
В нашем центре было проведено более раннее, небольшое, но проспективное и рандомизированное исследование по наблюдению пациентов с HBeAg-отрицательным гепатитом после терапии NA. В отличие от предыдущих исследований, основной конечной точкой был не рецидив ДНК HBV, а показатели клиренса HBsAg и долгосрочный иммунологический контроль, определяемый как уровень ДНК HBV <2000 МЕ / мл. Для этого пациенты были оценены в течении 144 недель после отмены монотерапии тенофовиром (TDF). Пациенты, которые были включены в исследование, имели недетектируемую ДНК HBV в течение 3,5 лет и были случайным образом назначены либо на остановку (n = 21), либо на продолжение (n = 21) монотерапии TDF. После прекращения TDF, ДНК HBV обнаруживалась у всех пациентов. Однако в общей сложности 62% (n = 13) оставались вне терапии 144 недель (рисунок 3). Медианное снижение HBsAg в этой группе составляло 0,59 log10 МЕ / мл (диапазон 4,49-0,02 log10 МЕ / мл) по сравнению с 0,21 log10 IU / mL у пациентов, которые продолжали TDF. Четыре пациента (19%) достигли потери HBsAg (P = 0,022). Повышенные уровни АЛТ наблюдались у некоторых пациентов во время внетерапевтического периода. На 144 неделе уровни ALT были <2 × ULN у всех пациентов, которые были вне терапии. Восемь пациентов должны были возобновить терапию с помощью TDF в соответствии с нашими критериями повторного лечения. Хотя число пациентов, включенных в наше исследование, было небольшим, наблюдается заметное сходство между показателями ответов в этом исследовании и данными Hadziyannis и соавторов. Одним из ключевых результатов нашего исследования было то, что, как и в других исследованиях, все пациенты испытывали рецидив в уровнях ДНК HBV, который был временным, и большинство пациентов имели спонтанное снижение ДНК HBV до уровня ниже уровня, требующего лечения (рисунок 2).
Рисунок 3:
 ПРОГНОЗИРОВАНИЕ ПОЛОЖИТЕЛЬНОЙ РЕАКЦИИ
ПРОГНОЗИРОВАНИЕ ПОЛОЖИТЕЛЬНОЙ РЕАКЦИИ
Факторами, которые, как было показано, связаны с ответом на лечение после терапии NA, являются более ранний возраст, низкие уровни ДНК ALT и HBV в начале исследования и продолжительность консолидирующей терапии. Хотя уровень HBsAg также был признан маркером для прогнозирования ответа на лечение после терапии NA. Некоторые исследования показали, что уровни HBsAg в конце терапии NA могут быть хорошим прогностическим фатором для пациентов, нуждающихся в повторном лечении. Chen et al обнаружили, что значения HBsAg 120 и 200 МЕ / мл были положительными прогностическими маркерами ответа на лечение. Lee et al и другие идентифицировали уровни HBsAg <2 log10 МЕ / мл как надежный предиктор устойчивого ответа на лечение. В исследовании Berg et al, пациенты, которые достигли снижения HBsAg после отмены лечения имели исходные уровни HBsAg <25 000 МЕ / мл при прекращении лечения NA. Другие результаты показали, что уровни HBsAg не были полезны при идентификации ответчиков на лечение NA. Новые маркеры репликации HBV также были оценены для их использования при прогнозировании ответа после лечения NA. Одним из них является коровый HBV антиген (HBcrAg), определяемый методом иммуноанализа, который одновременно обнаруживает HBeAg, HBcAg и p22cr. Результаты исследований в азиатских популяциях, в основном с генотипами HBV B и C, свидетельствуют о том, что HBcrAg может быть потенциальным маркером для прогнозирования благоприятного исхода после прекращения терапии NA. Низкие уровни HBcrAg были связаны с более низким риском биохимических рецидивов после прекращения терапии ламивудином. Рекомендации по использованию уровней HBcrAg для оценки рисков после прекращения были предложены и включены в руководящие принципы Японского общества гепатологии (JSH) для лечения инфекции HBV. Эти рекомендации основаны на оценке, которые включают в себя уровни HBsAg и HBcrAg для остановки терапии NA у пациентов, которые лечились в течение не менее 2 лет и имели необнаруживаемую HBV-ДНК и которые HBeAg отрицательны. Таким образом, HBeAg-отрицательные пациенты, которые отвечают на лечение NA не менее 2 лет и с уровнями HBsAg <1,9 log10 МЕ / мл, а также уровнями HBcrAg <3,0 log10 МЕ / мл имеют низкую вероятность рецидива ДНК HBV после окончания лечения NA.
РЕКОМЕНДАЦИИ ПО БЕЗОПАСНОСТИ ОСТАНОВКИ ТЕРАПИИ NUCs
Биохимический рецидив вызывает беспокойство у пациентов, перенесших лечение NA, особенно у пациентов с развитым фиброзом, циррозом или другими тяжелыми сопутствующими заболеваниями. С другой стороны, неясно, коррелирует ли уровень и продолжительность подъемов ALT с силой иммунного контроля над инфекцией HBV, которая возникает у некоторых пациентов. Таким образом, необходимо выяснить природу биохимических вспышек, чтобы иметь адекватное и безопасное управление пациентами. В метаанализе 25 отобранных исследований биохимический рецидив после прекращения NA был зарегистрирован у 28/72 (39%) пациентов с циррозом в начале исследования. Декомпенсация печени была описана у 2/243 (0,8%) пациентов с базовым циррозом. В большом проспективном исследовании, проведенном Seto et al, у 26% пациентов был повышенный уровень АЛТ, а у 12% был ALT> 2 × ULN после вирусологического рецидива. Средний уровень ALT у пациентов был 97 (диапазон 37-1058) U / L, у 88,1% (n = 37), происходящим на 12 или 24 неделе. Ни у одного из этих 42 субъектов не было существенного увеличения билирубина. Чтобы установить адекватные меры безопасности, не прерывая триггер иммунного контроля слишком рано, исследование в нашем центре имело следующие правила для инициации повторного лечения:
● подтверждение (т.е. два последовательных результата в центральной лаборатории) увеличение прямого билирубина от исходного уровня с сохранением ALT ULN;
● подтверждение устойчивого увеличения протромбинового времени ≥2,0 секунды от исходного уровня с соответствующей терапией витамина K и одновременно повышенными ALT;
● подтверждение повышенного уровня ALT 10 × ULN с или без связанных с этим симптомов;
● ALT 2 × ULN и ≤5 × ULN, сохраняющихся в течение ≥84 дней (12 недель), а также рецидив ДНК HBV ≥20 000 копий / мл и v) ALT 5 × ULN и ≤10 × ULN, сохраняющиеся в течение 28 дней (4 недели). Никаких неожиданных побочных эффектов не наблюдалось ни в одной из групп. У двух пациентов, которые возобновили TDF, было увеличение уровней ALT, которое было классифицировано как тяжелое неблагоприятное событие.
ВЫВОД
Точный механизм серологического исследования HBsAg до сих пор неясен, и нет целевого лечения для достижения этой конечной точки. Однако оценка отмены лечения NA у HBeAg-негативных пациентов показала более высокие показатели потерь HBsAg, чем в исследованиях с долгосрочной терапией NA или при комбинированной (NA + IFN). Это привело к включению возможного варианта лечения в недавние европейские руководящие принципы лечения инфекции HBV. Существующие исследования далее предполагают, что помимо серологического ответа (например, потери HBsAg) может также иметь место эффективный иммунный контроль хронической инфекции HBV , характеризующийся индукцией состояния носителя (т.е. HBeAg-отрицательная инфекция HBV) с сохранением подавления репликации HBV до низких или неопределяемых уровней. Хотя прекращение лечения сопровождается вирусологическим рецидивом почти у всех пациентов, эти рецидивы могут считаться приемлемым побочным эффектом. Также можно ожидать, что уровни ДНК HBV самопроизвольно возвращаются к низким или даже необнаружимым уровням у большинства пациентов; Таким образом, могут быть разработаны адекватные правила для возобновления лечения, чтобы предотвратить тяжелые биохимические рецидивы. Тем не менее, допустимый уровень циркулирующей ДНК HBV во время фазы лечения после NA не был определен; мы предполагаем, что приемлемо иметь уровни ДНК HBV, которые остаются постоянно ниже существующих в настоящее время пределов для начала лечения, который составляет <2000 МЕ / мл. Новые подходы к лечению находятся в стадии исследования в доклинических и ранних клинических испытаниях. Хотя данный подход не может непосредственно привести к излечению, эти стратегии могут помочь улучшить ответ на лечение, т. Е. способствовать восстановлению истощенных CD8 + Т-клеток путем снижения уровней HBsAg или снижения активности cccDNA. Механизм, лежащий в основе иммунологического контроля после прекращения лечения NA и роль прекращения лечения НС в повышении шансов достижения функционального излечения в связи с доступными и новыми вариантами лечения, должен быть определен в будущих исследованиях.




 Подробнее
Подробнее

