Tenofovir versus Placebo to Prevent Perinatal Transmission of Hepatitis B.
"Тенофовир против плацебо для профилактики перинатальной передачи гепатита В."
Jourdain G, Ngo-Giang-Huong N, Harrison L, Decker L, Khamduang W, Tierney C, Salvadori N, Cressey TR, Sirirungsi W, Achalapong J, Yuthavisuthi P, Kanjanavikai P, Na Ayudhaya OP, Siriwachirachai T, Prommas S, Sabsanong P, Limtrakul A, Varadisai S, Putiyanun C.
https://www.ncbi.nlm.nih.gov/pubmed/29514030
ЗАДНИЙ ПЛАН:
Беременные женщины с высокой вирусной нагрузкой вируса гепатита B (HBV) имеют риск передачи инфекции своим младенцам, несмотря на то, что они получают иммунноглобулин против гепатита B.
МЕТОДЫ:
В этом многоцентровом двойном слепом клиническом исследовании, проведенном в Таиланде, беременным женщинам с HBeAg положительным ХГВ, уровнем аланинаминотрансферазы 60 МЕ или менее на литр случайным образом было назначено лечение тенофовиром дизопроксилфумарат (TDF) или плацебо от 28 недель беременности до 2 месяцев после родов. Младенцы получали иммунноглобулин против гепатита В при рождении и вакцину против гепатита В при рождении по схеме: 1, 2, 4 и 6 месяцев. Первичной конечной точкой было: положительный результат HBsAg у младенца, подтвержденный уровнем ДНК HBV в возрасте 6 месяцев. Мы подсчитали, что выборка из 328 женщин была достаточной для обнаружения разницы не менее 9 процентных пунктов в вероятности вертикальной передачи (ожидаемая ставка: 3% в группе TDF против 12% в группе плацебо).
РЕЗУЛЬТАТЫ:
С января 2013 года по август 2015 года мы зарегистрировали 331 женщину; 168 женщин были случайным образом назначены в группу TDF и 163 в группу плацебо. При зачислении средний срок беременности составлял 28,3 недели, а средний уровень ДНК HBV составлял 8,0 log 10 МЕ на мл. Из общего числа 322 родов (97% участников) было 319 однорожденных, две пары-близнецов и один мертворожденный ребенок. Среднее время от рождения до введения иммунноглобулина против гепатита В составляло 1,3 часа, а среднее время от рождения до введения вакцины против гепатита В составляло 1,2 часа. В первичном анализе ни один из 147 младенцев (0%, 95% доверительный интервал [CI], 0 до 2) в группе TDF не был инфицирован по сравнению с 3 из 147 (2%, 95% ДИ, от 0 до 6 ) в группе плацебо (P = 0,12). Частота побочных эффектов не различалась между группами. Уровень аланинаминотрансферазы более 300 МЕ на литр после прекращения экспериментального режима у матерей составила 6% в группе TDF и 3% в группе плацебо (P = 0,29).
ВЫВОДЫ:
В условиях, когда вероятность передачи вируса HBV от матери к ребенку была низкой при применении иммуноглобулина против гепатита B и вакцины против гепатита B, родившихся у HBeAg-положительных матерей, дополнительное использование TDF не приводило к значительному более низкой вероятности передачи. (Финансируется Национальным институтом детского здоровья и развития человека Юниса Кеннеди Шрайвера, номер клинического трайла NCT01745822).
Участники
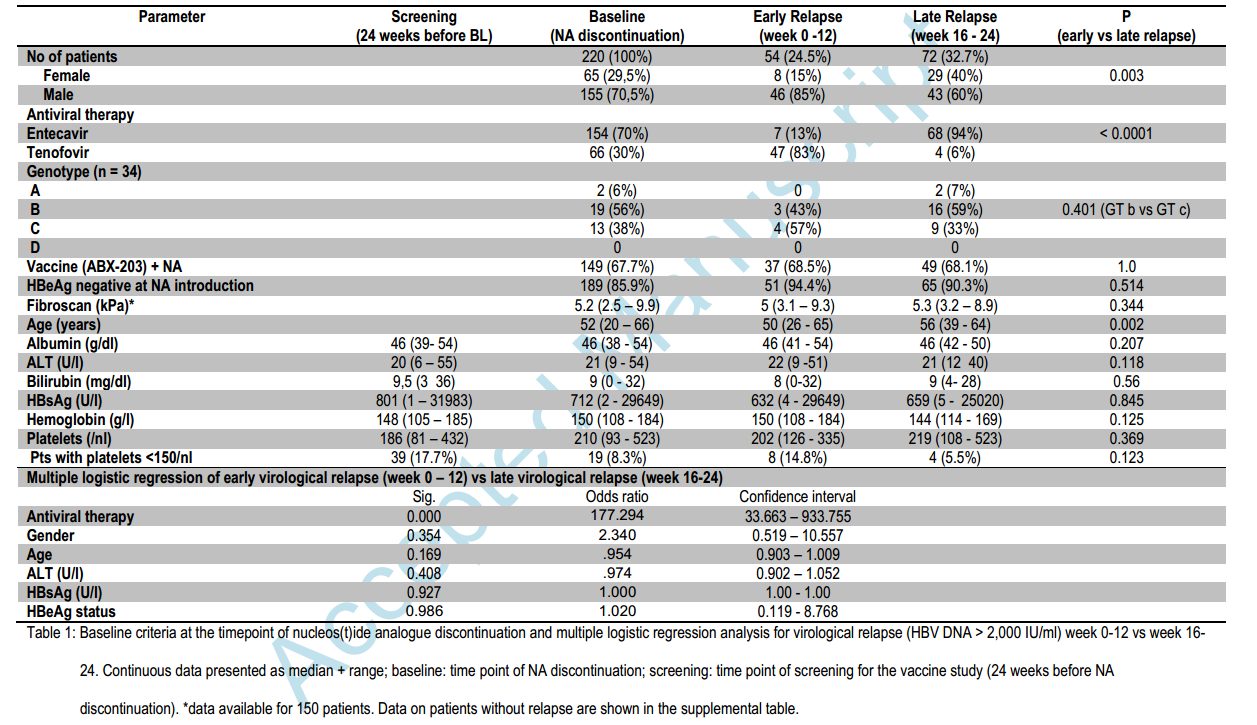
Среди 2512 HBsAg-положительных беременных женщин, которые были оценены на предмет приемлемости, 1470 (59%) были отрицательными по HBeAg и 711 (28%) были исключены по другим причинам (рис.1). С 8 января 2013 года и 19 августа 2015 года в общей сложности 331 женщина была рандомизирована, из которых 168 был назначен TDF и 163 - плацебо. В общей сложности 5 женщин (2 в группе TDF и 3 в группе плацебо) были ошибочно зарегистрированы с незначительными нарушениями критериев включения (2 женщины имели нормогликемическую гликозурию, 2 имели антитела против вируса гепатита С и 1 имели уровень аланинаминотрансферазы> 30 МЕ на литр при скрининге, но <60 МЕ на литр при зачислении). Характеристики женщин в обеих группах были одинаковыми (Таблица 1). Ни одна женщина не подвергалась амниоцентезу. В общей сложности 322 женщины (97% участников) родили 324 ребенка, в том числе 319 однорожденных, две пары близнецов и один мертворожденный младенец (близнецы и мертворожденный ребенок были в группе TDF). В общей сложности 294 новорожденных (147 в группе TDF и 147 в группе плацебо) наблюдались в течении 6 месяцев (рис.1). Все зарегистрированные женщины получали по меньшей мере одну дозу TDF или плацебо. Средняя продолжительность от регистрации до родов составляла 10,7 недели (межквартильный диапазон, от 10,0 до 11,6). В общей сложности 306 женщин (92%), в том числе 152 из 168 женщин (90%) в группе TDF и 154 из 163 (94%) в группе плацебо, завершили пробную терапию. Процент женщин, которые придерживались режима лечения, с приверженностью, определяемой тем, что они взяли по меньшей мере 80% таблеток за предыдущий 4-недельный период, составлял 93% на 32 неделе беременности, 94% на 36 неделе беременности, 86 % при доставке, 92% через 1 месяц после родов и 84% через 2 месяца после родов. Процент приверженности варьировался от 83 до 94% в группе TDF и от 85 до 95% в группе плацебо. Средняя продолжительность от рождения до введения вакцины против гепатита В составляла 1,2 часа (межквартильный диапазон 0,7-2,2). Только 12 младенцев (4%) получили вакцину более чем через 4 часа после рождения. Медианная продолжительность от рождения до введения иммунноглобулина против гепатита В составляла 1,3 часа (межквартильный диапазон от 0,8 до 2,5). В общей сложности 3 ребенка не получали иммуноглобулин против гепатита В, в том числе 1 ребенок в группе плацебо, который родился с отклонениями и умер вскоре после рождения без оценки маркеров HBV, и 2 ребенка в группе TDF (в родильном отделении, матери не идентифицировали себя в качестве участников процесса).
Таблица 1


Эффективность
В первичном анализе ни один из 147 младенцев в группе TDF и 3 из 147 (2%, 95% ДИ, от 0 до 6) в группа плацебо имели HBV-инфекцию через 6 месяцев (P = 0,12) (таблица 2). Аналогичные результаты дали анализы чувствительности. У матерей всех 3 инфицированных детей уровень ДНК HBV составлял более 7,8 log10 МЕ на миллилитр при родах. У 2 инфицированных детей HBsAg и ДНК HBV были последовательно обнаружены с рождения. У третьего инфицированного ребенка, который был рожден с помощью кесарева сечения и которого кормили грудью, HBsAg и ДНК HBV были впервые обнаружены в возрасте 6 месяцев. Анализ последовательности показал, что мать и младенец были инфицированы близкородственными вирусами, оба генотипа B. Через 6 месяцев 292 из 294 детей (99%) имели уровень антител к HBsAg по меньшей мере 10 МЕ на литр, включая всех 147 младенцев (100%) в группе TDF и 145 из 147 (99%) в группе плацебо (P = 0,25). 2 ребенка с низким уровнем антител к HBsAg имели HBV-инфекцию. Уровень антител к HBsAg у третьего инфицированного новорожденного снижался с 76 МЕ на литр в течение 1 месяца до 27 МЕ на литр через 2 месяца и до 12 МЕ на литр через 6 месяцев, что, вероятно, отражало выведение иммунноглобулина гепатита В, вводимого при рождении, без ответа на вакцину. Ни у одного из 3 инфицированных детей не было выявлено HBV через 12 месяцев. Уровень ДНК HBV у матерей снижался в группе TDF, со среднего значения 7,6 log10 IU на миллилитр в начале исследования до среднего значения 1 log 10 I МЕ на миллилитр при рождении, тогда как в группе плацебо не было изменений уровня ДНК HBV (P <0,001 для сравнения между группами при доставке) (таблица 2). При родах у 19 из 161 женщины (12%) в группе TDF уровень ДНК HBV составлял более 200 000 МЕ на миллилитр, по сравнению с 143 из 159 (90%) в группе плацебо. В общей сложности 10 женщин (6%) в группе TDF и 1 (1%) в группе плацебо имели уровень ДНК HBV ниже предела обнаружения (<15 МЕ на миллилитр) (таблица 1). 19 женщин из группы TDF, у которых уровень ДНК HBV был более 200 000 МЕ на миллилитр при родах, имели средний уровень ДНК HBV 8,5 log10 МЕ на миллилитр в начале исследования, а 5 имели плохую приверженность к испытательному режиму (взяли < 80% таблеток в предыдущий 4-недельный период).

Безопасность
После прекращения экспериментального режима острое обострение (определяемое как уровень аланинаминотрансферазы> 300 МЕ на литр) произошло у 9 из 154 женщин в группе TDF и у 5 из 157 (3%, 95% ДИ, от 1 до 7) в группе плацебо (P = 0,29) (таблица 2). Все обострения были бессимптомными. На рисунке 2 показаны продольные уровни аланинаминотрансферазы среди 17 женщин (9 в группе TDF и 8 в группе плацебо), у которых были вспышки во время исследования и после прекращения. Вспышки у женщин в группе TDF произошли после отмены TDF. Ни одна женщина не начала или не возобновляла TDF после вспышек, которые произошли в течение 6 месяцев после родов. Проведена оценка потенциального развития резистентности к TDF. В общей сложности 41 из 168 женщин (24%) в группе TDF и 44 из 163 (27%) в группе плацебо имели по крайней мере одно неблагоприятное событие (P = 0,62) (таблица 2). Наиболее частым событием было повышение уровня аланинаминотрансферазы (у 31 женщины [18%] в группе TDF и 24 [15%] в группе плацебо), за которой следуют послеоперационные осложнения (у 6 [4%] и 13 [8 %], соответственно), включая одно мертворождение (в группе TDF). Женщины в группе плацебо, как правило, имели первое неблагоприятное событие раньше, чем в группе TDF, но через 6 месяцев после родов не было существенной разницы между группами (P = 0,50) (фиг.3A). В общей сложности 43 младенца (27%) у 161 матерей в группе TDF и 38 младенцев (24%) у 160 матерей в группе плацебо имели по крайней мере одно неблагоприятное событие 3 или 4 класса или классифицируемое как серьезное (P = 0,61) (таблица 2). Наиболее частым нежелательным явлением являлась желтуха или гипербилирубинемия (у 24 младенцев [15%] в группе TDF и 17 [11%] в группе плацебо). Как упоминалось ранее, один ребенок в группе плацебо родился с грубыми отклонениями и умер вскоре после рождения. Время до первого неблагоприятного события существенно не различалось между группами (P = 0,62) (фиг.3B). Измерения роста младенцев в течение 6 месяцев существенно не различались между группами (P≥0,09 для всех сравнений) (таблица 2), а аналогичный рост с течением времени наблюдался в двух группах (рис. S1 в дополнительном приложении).



 Подробнее
Подробнее