Данные рекомендации утверждены Американской ассоциацией по изучению заболеваний печени (AASLD) и одобрены Американским обществом инфекционных заболеваний, Американской коллегией гастроэнтерологов и Национальным круглым столом по вопросам вирусного гепатита.
Преамбула
Данные рекомендации представляют собой методику, подкрепленную данными проведенных исследований. Они основаны на: (1) официальной оценке и анализе недавно опубликованных в мировой литературе данных по этому вопросу (найденных в базе MED-LINE до июня 2011 г.); (2) руководстве по оценке врачебной практики и разработке практических рекомендаций Американской коллегии врачей1, (3) руководящих принципах разработки рекомендаций, включая Политику в области разработки и применения практических рекомендаций Американской ассоциации по изучению заболеваний печени (AASLD)2; и (4) опыте авторов в отношении гепатита С.
Рекомендации предназначены для врачей и описывают предпочтительные методы диагностики, лечения и профилактики гепатита Cгенотипа 1, 2, 3, 4. Они намеренно сделаны гибкими, в отличие от стандартов лечения, представляющих собой не допускающие изменения методики, которых необходимо придерживаться в любом случае. Конкретные рекомендации основаны на опубликованной информации по данному вопросу. Для более полной характеристики доказательств, подтверждающих рекомендации, Комитет по практическим рекомендациям AASLD требует для каждой рекомендации сообщать о Классе (отражает соотношение риска и пользы) и Уровне (оценивает степень достоверности) ее доказательности (таблица 1, адаптирована из практических рекомендаций Американской Коллегии Кардиологов и Американской ассоциации изучения сердечных заболеваний). 3,4
Введение
Стандарт лечения (SOC) для пациентов с хроническим инфицированием вирусом гепатита С (HCV) использует пегинтерферон (PegIFN) рибавирин (RBV). Эти препараты вводятся в течение 48 (HCV генотипов 1, 4, 5 и 6) или 24 недель (HCV генотипов 2 и 3), включая стойкий вирусологический ответ (SVR) у 40%-50% пациентов с инфицированием генотипом 1 и более 80% у пациентов с инфицированием генотипом 2 и 3.5-7 После достижения SVR ассоциируется с длительным клиренсом инфекции HCV, который рассматривается, как вирусологическое "выздоровление", а также с улучшенными показателями заболеваемости и смертности.8-10
С момента последнего обновления рекомендаций были достигнуты два крупных успеха в лечении хронического гепатита С (СНС), которые изменили оптимальные режимы лечения хронической инфекции HCV генотипа 1: разработка антивирусных препаратов прямого действия (DAA)11-17 и идентификация нескольких одиночных нуклеотидных полиморфизмов, связанных со спонтанным и вызванным лечением клиренсом инфекции HCV.18,19
Несмотря на то, что PegIFN и RBV остаются важными компонентами терапии, появление DAA привело к значительному улучшению показаний SVR и разработке варианта сокращенной терапии многих пациентов с хроническим HCV генотипа 1. Поэтому необходимо изменение рекомендаций по лечению, но на основе данных, которых в настоящее время ее не достаточно. Соответственно этому, может понадобиться пересмотр некоторых рекомендаций после получения дополнительных данных. Данные рекомендации рассматривают вопрос о том, какое лечение хронической инфекции гепатита С генотипа 1 сейчас является оптимальным, но не исследуют проблему приоритезации выбора пациентов для лечения или лечения особых популяций населения.
Таблица 1. Система классификации для определения рекомендаций
|
Классификация |
Описание |
|
Класс 1 |
Имеются доказательства и/или общепризнанное мнение, что данная процедура диагностической оценки или метод лечения оказывают положительное воздействие, полезны и эффективны |
|
Класс 2 |
Имеются противоречивые доказательства и/или расхождения во мнениях, что данная диагностическая оценка, процедура или метод лечения полезны или эффективны |
|
Класс 2a |
Преобладание доказательств/мнений о том, что данный метод полезен/эффективен |
|
Класс 2b |
Полезность/эффективность метода установлена в меньшей степени на основании доказательств/мнений |
|
Класс 3 |
Имеются доказательства и/или общепризнанное мнение, что данная процедура диагностической оценки или метод лечения не являются полезными/эффективными и в некоторых случаях могут наносить вред |
|
Уровень доказательств |
Описание |
|
Уровень A |
Данные получены из многих рандомизированных исследований или мета-анализов |
|
Уровень B |
Данные получены из одного рандомизированного исследования или нерандомизированных исследований |
|
Уровень C |
Общепринятое экспертное мнение, случаи из практики или стандарт терапии |
Антивирусные препараты прямого действия
В жизненном цикле вирусов существует несколько этапов, которые являются потенциальными фармакологическими мишенями. В настоящее время для лечения ХГС разрабатывается ряд соединений, охватывающих не менее пяти различных классов лекарственных средств. На сегодняшний день только ингибиторы сериновой протеазы неструктурированного белка 3/4A (NS3/4A) вируса гепатита С были одобрены Управлением США по надзору за качеством пищевых продуктов и лекарственных средств (FDA).
Ингибиторы протеаз
Сериновая протеаза NS3/4A необходима для репликации РНК и сборки вириона. Два ингибитора сериновой протеазы NS3/4A, боцепревир (BOC) и телапревир (TVR), продемонстрировали мощное подавление репликации HCV генотипа 1 и значительное улучшение показателей частоты SVR у пациентов, не получавших и получавших лечение в прошлом.12,13,16,17 Ограниченное исследование фазы 2 показало, что TVR активно действует также против HCV генотипа 2, но не действует на генотип 3.20 Что касается BOC, то существуют ограниченные сведения, свидетельствующие, что он тоже активен против HCV генотипа 2, но действует также и на генотип 3.21 Однако в настоящее время ни один препарат не используется для лечения пациентов с HCV генотипов 2 или 3, а при введении в качестве монотерапии каждый ингибитор протеазы быстро выбирает варианты резистентности, что приводит к вирусологической неэффективности. Комбинирование ингибиторов протеазы с PegIFN и RBV ограничивает выбор вариантов резистентности и улучшает антивирусный ответ.15
Пациенты, никогда ранее не получавшие терапию
(наивные пациенты)
Боцепревир. Исследование SPRINT-2 оценивало BOC в двух когортах наивных пациентов: белой и черной расы.12 Количество пациентов в черной когорте, по сравнению с белой когортой, было небольшим и, возможно, недостаточным для обеспечения надлежащей оценки подлинного ответа в данной популяции. Все пациенты сначала получали PegIFN альфа-2b и рассчитанный по массе RBV в качестве вводной терапии в течение 4 недель, после чего следовал один из трех режимов лечения: (1) BOC, PegIFN и RBV, которые вводились в течение 24 недель, если на 8-й неделе исследований (4-й неделе тройной терапии) уровень РНК HCV не обнаруживался (как указано в листке-вкладыше, <10-15 МЕ/мл), что в дальнейшем именовалось терапией, модифицируемой в зависимости от выраженности ответа (RGT); если же, однако, РНК HCV определялась при каждом визите с 8-й недели по 24-ю (но не включая ее) (другими словами, наблюдался медленный вирусологический ответ), BOC отменялся и пациент получал стандартную терапию дополнительные 20 недель; (2) BOC, PegIFN и RBV, которые вводились в течение фиксированного срока - 44 недели; и (3) только PegIFN альфа-2b и рассчитанный по массе RBV, которые вводились дополнительные 44 недели, что представляло стандарт лечения (SOC).12 Доза BOC составляла 800 мг, вводилась перорально три раза в день вместе с едой. Общие показатели частоты SVR были выше в группе BOC (63% и 66%, соответственно), чем в группе SOC (38%), но отличались в зависимости от расы (Рис. 1). Показатели SVR среди белых пациентов составляли 67% в группе RGT, 69% в группе фиксированной длительности и 41% в группе стандартной терапии, соответственно.12 У пациентов черной расы показатели SVR составляли 42% в группе RGT, 53% в группе фиксированной длительности и 23% в группе стандартной терапии, соответственно (Рис. 1).12 Всего 54% белых реципиентов BOC показали быстрый вирусологический ответ (RVR; неопределяемая РНК HCV, <10-15 МЕ/мл на 8-й неделе, такой интервал выбран из-за 4-недельной вводной терапии). С другой стороны, только 20% чернокожих реципиентов BOC продемонстрировали RVR. Независимо от расы, среди тех пациентов, которые стали РНК HCV-негативными на 8-й неделе (~57% в группах BOC и 17% в группе SOC), показатели SVR составляли 88% в группе RGT, 90% в группе фиксированной длительности и 85% в группе стандартной терапии (SOC), по сравнению с показателями SVR 36%, 40% и 30%, соответственно, если РНК HCV все еще обнаруживалась на 8-й неделе (Рис. 2).12
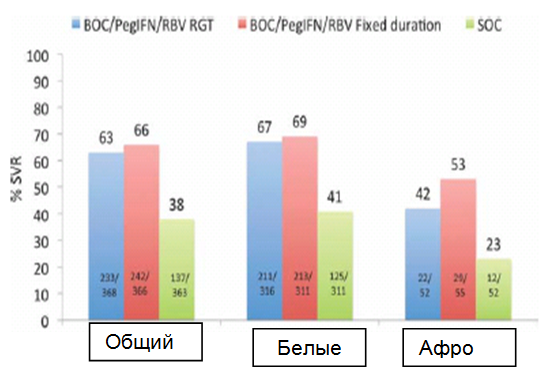
Рис.1 Все пациенты сначала проходили терапию PegIFN + RBV в течение 4 недель в качестве вводной терапии, после которой следовал один из трех режимов лечения: (1) BOC/PegIFN/RBVRGT – тройная терапия в течение 24 недель, при условии, что уровни РНК HCV были негативными с 8-й по 24-ю неделю - терапия, модифицируемая в зависимости от выраженности ответа; пациенты с определяемым уровнем РНК HCV на 8-24 неделе получали SOC в течение дополнительных 20 недель; (2) BOC/PegIFN/RBV в течение фиксированного периода – тройная терапия в течение фиксированного периода 44 недели; и (3) SOC – стандартная терапия, включающая PegIFN и рассчитанный по массе RBV, вводимые в течение 48 недель.12
В анализе по подгруппам показатели SVR были выше в режимах с использованием BOC по всем переменным величинам предварительного лечения, которые были определены в прошлых исследованиях как влияющие на ответ на стандартную терапию, включая повышенный фиброз, расу и высокую нагрузку вирусом HCV при предварительном лечении. Кроме того, показатель SVR в подгруппах был аналогичным в группе RGT и группе фиксированной длительности, поэтому AASLD и FDA поддерживают использование RGT для наивных пациентов без цирроза. FDA рекомендует не применять RGT для пациентов с компенсированным циррозом, однако такая рекомендация основывается на ограниченных данных и требует дальнейшего изучения. Примечательно, что если вирусологический ответ не удовлетворяет критериям для RGT, другими словами, мы имеем медленный вирусологический ответ, FDA рекомендует (на основании модели) тройную терапию в течение 32 недель, которой предшествует стандартная терапия в течение 4 недель, после чего следует терапия только PegIFN и RBV в течение 12 недель; стратегия, которая отличается от дизайна исследования фазы 3. Все виды терапии необходимо отменить, если уровень РНК HCV составляет ~100 МЕ/мл на 12-й неделе или ~10 - 15 МЕ/мл на 24 неделе.
Телапревир. Два исследования фазы 3 оценивали эффективность TVR в комбинации с PegIFN альфа-2a и RBV у наивных пациентов с хронической инфекцией HCV генотипа 1.16,22 Чернокожие пациенты входили в исследование, но не в виде отдельной когорты и количество их было не достаточным для надлежащей оценки подлинного ответа в данной популяции. В исследовании ADVANCE пациенты получали терапию TVR вместе с PegIFN и RBV в течение 8 (T8PR) или 12 (T12PR) недель, после чего следовала терапия только PegIFN и RBV по системе модификации в зависимости от выраженности ответа на лечение.16 Доза TVR составляла 750 мг и принималась перорально каждые 8 часов вместе с едой (в частности, с жирной). Пациенты в группах T8PR и T12PR, достигшие расширенного быстрого вирусологического ответа (eRVR) – который для данного препарата выражался в не определяемых уровнях РНК HCV (<10-15 МЕ/мл) на 4-й и 12-й неделе – прекратили терапию на 24-й неделе, тогда как пациенты, не достигшие eRVR, получали PegIFN и RBV в общем 48 недель. Общие показатели SVR среди пациентов в группах T8PR и T12PR составляли 69% и 75%, соответственно,16 по сравнению с показателем 44% в контрольной группе (Таблица 2 и Рис. 3). Используя метод RGT, 58% и 57% пациентов в группах T12PR и T8PR, соответственно, достигли eRVR, 89% и 83% из которых достигли SVR в конечном счете.16 Таким образом, развитие eRVR является самым значительным прогностическим фактором появления SVR.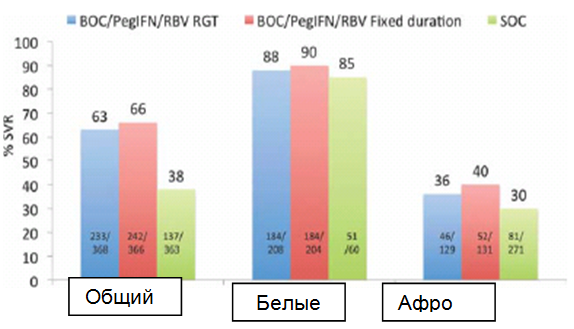
Рис. 2. Показатели стойкого вирусологического ответа (SVR), общий и основанный на быстром вирусологическом ответе, (RVR, не определяемая РНК HCV на 8-й неделе [4-й неделе тройной терапии]) у наивных пациентов с HCV генотипа 1: боцепревир (BOC) плюс пегинтерферон (PegIFN) по сравнению со стандартной терапией (SOC). Все пациенты сначала проходили терапию PegIFN + RBV в течение 4 недель в качестве вводной терапии, после которой следовал один из трех режимов лечения: (1) BOC/PegIFN/RBVRGT – пациенты, достигшие RVR (не определяемая РНК HCV на 8-й неделе [4-й неделе тройной терапии]) продолжали лечение еще 24 недели (RGT – терапия, модифицируемая в зависимости от выраженности ответа); если RVR не развивался, тройная терапия продолжалась до 28 недели, после чего следовала стандартная терапия в течение 20 недель. SOC включала PegIFN и RBV, принимаемые в течение 48 недель.12 Следует заметить, что общее количество RVR-позитивных и RVR-негативных пациентов не эквивалентно общему количеству зарегистрированных пациентов, возможно из-за отсутствия значений РНК HCV на 8-й неделе.
Показатели SVR были выше в режимах с использованием TVR по сравнению со стандартной терапией у пациентов с характеристиками болезни, которые ранее связывались с более слабым ответом на стандартную терапию. Хотя несколько чернокожих пациентов и другие популяции пациентов, трудно поддающихся лечению, были включены в исследование TVR фазы 3, улучшение показателя SVR наблюдалось независимо от расовой и этнической принадлежности или от степени фиброза печени. Что касается расы, то лечение с применением TVR значительно улучшало показатели SVR у чернокожих пациентов (T8PR, 58% и T12PR, 62%) по сравнению с показателями SVR, достигнутыми у пациентов, проходивших стандартную терапию (25%) (Рис. 3). Кроме того, показатель SVR был >80% у чернокожих пациентов, достигших eRVR при терапии с применением TVR. Всего 62% пациентов в группе T12PR и 53% в группе T8PR с развитым фиброзом достигли SVR, этот показатель улучшился до >80% у пациентов с eRVR. В группе T12PR влияние высокой вирусной нагрузки на показатели SVR по сравнению с низкой нагрузкой (>800 000 или <800 000 МЕ/мл) было минимальным; показатель SVR составлял 74% у пациентов с высокой вирусной нагрузкой, у пациентов с низкой вирусной нагрузкой он составлял 78%.
Таблица 2. Сравнение ингибиторов протеазы в комбинации с пегинтерфероном альфа (PegIFN) и рибавирином (RBV) у наивных пациентов
|
Переменная |
Боцепревир (BOC)12 |
Телапревир (TVR)16 |
|
Дизайн исследования |
RCT |
RCT |
|
4-недельная вводная терапия PeglFN/RBV |
Да |
Нет |
|
Длительность тройной терапии |
24 или 44 недели в комбинации |
12 недель с последующими 12 followed by 12 or |
|
|
с PeglFN/RBV* |
или 36 неделями терапии PeglFN/RBV+ |
|
Терапия, модифицируемая в зависимости от выраженности ответа (RGT) |
Да |
Да |
|
Пригодность для терапии, модифицируемой в зависимости от выраженности ответа (%) |
44 |
58 |
|
SVR (%) |
BOC44/PR: 66 |
T8PR: 69 |
|
|
BOC/PR/RGT: 63 |
T12PR: 75 |
|
|
SOC: 38 |
SOC: 44 |
|
Завершение периода терапии (%) |
BOC44/PR: 76 |
T8PR: 81 |
|
|
BOC/PR/RGT: 71 |
T12PR: 87 |
|
|
SOC: 53 |
SOC: 63 |
|
Рецидив (%) |
BOC44/PR: 9 |
T8PR: 9 |
|
|
BOC/PR/RGT: 9 |
T12PR: 9 |
|
|
SOC: 22 |
SOC: 28 |
|
Резистентность, появившаяся во время лечения (%) |
16 |
12 |
|
Нежелательные явления, чаще встречающиеся в группе тройной терапии по сравнению с SOC |
Анемия, дисгевзия |
Сыпь, анемия, кожный зуд, тошнота, диарея |
|
Нежелательные явления, приводящие к отмене терапии (%) |
NA |
12 |
|
Серьезные нежелательные явления исследуемого препарата по сравнению с SOC (%) |
11 против 9 |
9 против 7 |
NA - отсутствуют; PR – пегинтерферон плюс рибавирин; RCT – рандомизированные, контролируемы исследования; SOC – стандартная терапия; SVR – стойкий вирусологический ответ.
*Все пациенты сначала проходили терапию PegIFN альфа-2b и рассчитанным по массе RBV в течение 4 недель в качестве вводной терапии, после которой следовал один из трех режимов лечения: (1) BOC/PR/RGT: BOC, PegIFN и RBV, которые вводились в течение 24 недель, при условии, что уровень РНК HCV был неопределяемым на 8-й неделе (4-й неделе тройной терапии) (как указано в листке-вкладыше, <10-15 МЕ/мл), что в дальнейшем именовалось терапией, модифицируемой в зависимости от выраженности ответа (RGT); если же, однако, РНК HCV определялась при каждом визите с 8-й недели по 24-ю (но не включая ее) (другими словами, наблюдался медленный вирусологический ответ), BOC отменялся и пациент получал стандартную терапию дополнительные 20 недель; (2) BOC44/PR: BOC, PegIFN и RBV, которые вводились в течение фиксированного срока - 44 недели; и (3) SOC: только PegIFN альфа-2b и рассчитанный по массе RBV, которые вводились дополнительные 44 недели
†Телапревир (TVR) плюс пегинтерферон и рибавирин (PR) в течение 8 (T8PR) или12 (T12PR) недель по сравнению со стандартным лечением (SOC). Пациенты в группах T8PR и T12PR, достигшие расширенного быстрого вирусологического ответа (eRVR) – который для данного препарата выражался в не определяемых уровнях РНК HCV (<10-15 МЕ/мл) на 4-й и 12-й неделе – прекратили терапию на 24-й неделе, тогда как пациенты, не достигшие eRVR, получали PegIFN и RBV в общем 48 недель. Все пациенты в контрольной группе получали терапию PegIFN и RBV в течение 48 недель.
Рис. 3. Показатели стойкого вирусологического ответа (SVR), общий и отдельно по расам, у наивных пациентов с HCV генотипа 1: телапревир (TVR) плюс пегинтерферон и рибавирин (PR) в течение 8 (T8PR) или 12 (T12PR) недель по сравнению со стандартной терапией (SOC). Пациенты в группах тройной терапии, у которых развился eRVR (расширенный быстрый вирусологический ответ, который для данного препарата выражался в не определяемых уровнях РНК HCV (на 4-й и 12-й неделе) прекратили терапию на 24-й неделе (терапия, модифицируемая в зависимости от выраженности ответа, RGT); если eRVR не развивался, терапия продолжалась до 48 недель. Стандартная терапия (SOC) состояла из PegIFN и RBV, вводимых в течение 48 недель. 16
Исследования ILLUMINATE занимались определением эффективности RGT у пациентов с eRVR. Первые 12 недель все пациенты получали тройную терапию на базе TVR, после которой проходили лечение только PegIFN и RBV.22 Те пациенты, которые
достигли eRVR, были рандомизированы на 20-й неделе для получения PegIFN и RBV в течение дополнительных 4 или 28 недель, тогда как пациенты, не достигшие eRVR, не рандомизировались и получали PegIFN и RBV в течение дополнительных 28 недель. Общий показатель частоты SVR для всех пациентов составил 72% (Рис. 4), аналогичный показатель – до 75%, наблюдался в исследовании ADVANCE.22 У 65% пациентов, не достигших eRVR и получавших PegIFN и RBV в течение дополнительных 4 или 28 недель, показатели частоты SVR составляли 92% и 88%, соответственно (Рис. 4). В противоположность этому, показатель SVR у пациентов, которые не достигли eRVR, составлял всего 64%.22 Эти данные дают возможность предположить, что стратегия модификации лечения в зависимости от выраженности ответа на основании eRVR позволяет сократить длительность терапии без риска ухудшения показателя
SVR и подходит для двух третей пациентов с хронической инфекцией HCV генотипа 1. Однако использование RGT не подходит для пациентов с циррозом печени, но в настоящее время недостаточно данных для проведения терапии в этой сложной популяции. Терапия должна быть прекращена у всех пациентов, если уровни РНК HCV составляют ?1,000 МЕ/мл на 4-й или 12-й неделе и/или >10-15 МЕ/мл на 24-й неделе.
Рис. 4. Стойкий вирусологический ответ (SVR) при лечении наивных пациентов с HCV генотипа 1: результаты по терапии телапревиром (TVR) плюс пегинтерфероном и рибавирином (PR), общие и среди пациентов, которые достигли или не достигли eRVR (расширенного быстрого вирусологического ответа; не обнаруживаемая РНК HCV на 4-й и 12-й неделе). Пациенты, достигшие eRVR, были рандомизированы на 20-й неделе для прохождения стандартной терапии в течение дополнительных 4 или 28 недель; пациенты, у которых не развился eRVR, не были рандомизированы и все получали стандартную терапию в течение 24 недель. 22
Рекомендации:
1. Оптимальной терапией для хронического HCV генотипа 1 является использование боцепревира или телапревира в комбинации с пегинтерфероном альфа и рибавирином (класс 1, уровень А).
2. Боцепревир и телапревир не должны использоваться без пегинтерферона альфа и рассчитанного по массе тела рибавирина (класс 1, уровень А).
Для лечения наивных пациентов:
3. Рекомендуемая доза боцепревира 800 мг вводится одновременно с приемом пищи три раза в день (каждые 7 – 9 часов) вместе с пегинтерфероном альфа и рассчитанным по массе тела рибавирином в течение 24 – 44 недель, чему предшествует 4 недели вводной терапии только пегинтерфероном альфа и рибавирином (класс 1, уровень А).
4. Пациентам без цирроза, получающим терапию боцепревиром, пегинтерфероном и рибавирином, которой предшествует 4-недельная вводная терапия пегинтерфероном и рибавирином, и уровень РНК HCV у которых не обнаруживается на 8-й и 24-й неделе, можно сократить период лечения в общей сложности до 28 недель (4 недели вводная терапия пегинтерфероном и рибавирином и 24 недели тройной терапии) (класс 2а, уровень В).
5. Лечение всеми тремя препаратами (боцепревиром, пегинтерфероном и рибавирином) должно быть прекращено, если уровень РНК HCV составляет более >100 МЕ/мл на 12-й неделе лечения или обнаруживается на 24-й неделе лечения (класс 2а, уровень В).
6. Рекомендованная доза телапревира 750 мг принимается одновременно с приемом пищи (не с низким содержанием жиров) три раза в день (каждые 7 – 9 часов) вместе с пегинтерфероном альфа и рассчитанным по массе тела рибавирином в течение 12 недель, после чего в течение дополнительных 12 – 36 недель принимается пегинтерферон альфа и рибавирин (класс 1, уровень A).
7. Пациентам без цирроза, получающим терапию телапревиром, пегинтерфероном и рибавирином, уровни РНК HCV у которых не обнаруживаются на 4-й и 12-й неделе, можно сократить длительность терапии до 24 недель (класс 2а, уровень А).
8. Пациенты с циррозом, принимающие боцепревир или телапревир в комбинации с пегинтерфероном и рибавирином, должны получать терапию в течение 48 недель (класс 2b, уровень В).
9. Лечение всеми тремя препаратами (телапревиром, пегинтерфероном альфа и рибавирином) должно быть прекращено, если уровень РНК HCV составляет >1,000 МЕ/мл на 4-й или 12-й неделе лечения и/или обнаруживается на 24-й неделе (класс 2а, уровень В).
Пациенты, ранее получавшие терапию
Для лиц, получавших ранее терапию от ХГС, но лечение которых было неэффективным, определены три категории. Нон-респондеры (не ответившие на терапию) – лица, уровень РНК HCV у которых не снизился не менее чем на 2 log МЕ/мл на 12-й неделе лечения; частичные респондеры (пациенты, частично ответившие на терапию) – лица, уровень РНК HCV у которых снизился не менее чем на 2 log МЕ/мл на 12-й неделе лечения, но все еще обнаруживался на 24-й неделе лечения; и пациенты с рецидивом – лица, РНК HCV у которых перестала обнаруживаться во время лечения, но после окончания лечения появилась снова. Принимая во внимание данные категории, исследования фазы 3 проводились также у пациентов с хронической инфекцией HCV генотипа 1, принимавших лечение BOC и TVR в комбинации с PegIFN и RBV. Дизайн исследования BOC включал 4-недельную вводную фазу приема PegIFN и RBV и сравнивал тройную терапию, модифицируемую в зависимости от выраженности ответа (BOC плюс PegIFN и RBV в течение 32 недель; пациенты с обнаруживаемым уровнем РНК HCV на 8-й неделе получали стандартную терапию SOC дополнительно 12 недель), и тройную терапию в течение фиксированного периода 44 недели (всего 48 недель терапии) со стандартной терапией (SOC).13 Дизайн исследования TVR включал три группы: в первой группе пациенты получали тройную терапию в течение 12 недель, после чего следовала стандартная терапия в течение 36 недель; во второй группе пациенты получали вводное стандартное лечение в течение 4 недель, затем тройную терапию в течение 12 недель и, наконец, стандартную терапию в течение 32 недель; третья группа получала стандартную терапию в течение 48 недель.17 В обоих исследованиях SVR возникал значительно чаще у пациентов, получавших тройную терапию, чем у тех, кто получал стандартную терапию. В исследовании BOC (RESPOND-2), частота SVR составляла 66% и 59% в двух группах тройной терапии по сравнению с 21% в контрольной группе, пациенты с рецидивом в прошлом достигали SVR чаще (75% и 69%, соответственно), чем частичные респондеры (52% и 40%, соответственно) в сравнении с показателями, достигнутыми в группе стандартной терапии (29% and 7%, соответственно); нон-респондеры были исключены из данного исследования (Таблица 3 и Рис. 5).13 Аналогично, показатели SVR в исследовании TVR (REALIZE) составляли 64% и 66% в группах, использующих TVR (83% и 88% у пациентов с рецидивом, 59% и 54% у частичных респондеров, 29% и 33% у нон-респондеров), и 17% в контрольной группе (24% у пациентов с рецидивом, 15% у частичных респондеров и 5% у нон-респондеров) (Рис. 6).17 Таким образом, ответ на режимы тройной терапии в обоих исследованиях BOC и TVR зависел от результата предшествующего лечения PegIFN и RBV, что подчеркивает важность просмотра старых медицинских карт для документирования ответа на предыдущее лечение. В исследовании BOC частота SVR была выше у пациентов с рецидивом, чем у частичных респондеров. В исследованиях TVR также самый высокий показатель SVR наблюдался у пациентов с рецидивом в прошлом, более низкий – у частичных респондеров и самый низкий – у нон-респондеров (определяемых как пациенты, снижение уровня РНК HCV у которых при предыдущем лечении было <2 log10 на 12-й неделе) (Таблица 3 и Рис. 6).17
Таким образом, решение о повторном лечении пациентов должно зависеть от их ответа на предыдущее лечение PegIFN и RBV, а также от причин его неэффективности, таких как ненадлежащая доза препарата или побочные эффекты. Для пациентов с рецидивом или частичных респондеров может ожидаться относительно высокий показатель SVR при повторном лечении по тройным PI-содержащим схемам и должны быть рассмотрены кандидаты для повторного лечения. Решение по повторному лечению нон-респондеров должно быть индивидуальным, особенно для пациентов с циррозом, поскольку менее одной трети нон-респондеров в исследовании TVR достигали SVR; сравнительных данных по BOC не существует, поскольку нон-респондеры были исключены из лечения. Кроме того, у большинства нон-респондеров развилась антивирусная устойчивость. Маркировка FDA, однако, указывает, что BOC можно использовать для нон-респондеров, но, при отсутствии окончательных данных фазы 3, рекомендуется соблюдать осторожность при использовании ВОС для нон-респондеров до получения дополнительных подтверждающих данных. Соответственно, любая потенциальная польза для лечения нон-респондеров должна соотноситься с риском развития антивирусной устойчивости и серьезных побочных эффектов, а также с высокой стоимостью терапии.
Терапия, модифицируемая в зависимости от достижения eRVR, оценивалась для повторного применения в исследовании BOC. Сокращение длительности терапии со стандартных 48 до 36 недель у пациентов, получавших терапию и достигших eRVR (который для данного препарата определяется как негативная РНК HCV в промежутке между 8-й и 20-й неделями) не очень снижало
показатель частоты SVR (59% для RGT и 66% для фиксированной продолжительности терапии).13 У пациентов с циррозом, однако, показатель SVR был статистически более низким у тех, кто получал RGT терапию, чем у тех, кто проходил полную терапию в течение 48 недель (35% и 77%, соответственно).13 Появление резистентности к ВОС чаще встречалось у пациентов, слабо отвечавших на лечение интерфероном (уменьшение уровня РНК HCV<1 log) во время вводной фазы и проходивших терапию RGT, по сравнению с теми, кто продемонстрировал снижение уровня РНК HCV >1 log и лечился 48 недель (32% и 8%, соответственно).13 Сравнительных данных по RGT с использованием TVR не существует. Однако показатели SVR практически одинаковые у пациентов с рецидивом и у наивных пациентов, а экспозиция TVR продолжалась 12 недель и в схеме RGT, и в схеме 48-недельного лечения. Соответственно, хотя и нет данных в поддержку рекомендации о том, что пациентов с рецидивом можно лечить TVR по схеме RGT, FDA поддерживает такую рекомендацию, поскольку такие данные есть для ВОС.
Таблица 3. Сравнение ингибиторов протеазы в комбинации с пегинтерфероном альфа (PegIFN) и рибавирином (RBV) у пациентов, получавших терапию ранее
|
Переменная |
Боцепревир13 (BOC)13 |
Телапревир (TVR)17 |
|
Дизайн исследования |
RCT |
RCT |
|
4-недельная вводная терапия PeglFN/RBV |
Да |
Да/Нет* |
|
|
| |
|
Продолжительность периода тройной терапии |
32 или 44 недели в комбинации |
12 недель, после чего |
|
36 недель | ||
|
с PegIFN и RBV** |
PeglFN и RBV*** | |
|
Терапия, модифицируемая в зависимости от выраженности ответа (RGT)
|
Да |
Нет |
|
|
| |
|
Пригодность для RGT (%)
|
46 |
NA |
|
Ответ на терапию PegIFN/RBV в прошлом (%) |
| |
|
Пациент с рецидивом |
64 |
53 |
|
Частичный респондер |
36 |
19 |
|
Нон-респондер |
NA |
28 |
|
Эффективность, SVR (%) |
|
|
|
Пациент с рецидивом |
BOC/PR48: 75 |
T12/PR48: 83 |
|
|
BOC/RGT: 69 |
Ll-T12/PR48: 88 |
|
|
PR48: 29 |
PR48: 24 |
|
Частичный респондер |
BOC/PR48: 52 |
T12/PR48: 59 |
|
|
BOC/RGT: 40 |
Ll-T12/PR48: 54 |
|
|
PR48: 7 |
PR48: 15 |
|
Нон-респондер |
NA |
T12/PR48: 29 Ll-T12/PR48: 33 PR48: 5 |
|
Общее количество рецидивов, (%) |
12-15 |
NA |
|
Пациент с рецидивом |
NA |
T12/PR48: 7 Ll-T12/PR48: 7 PR48: 65 |
|
Частичный респондер |
NA |
T12/PR48: 21 Ll-T12/PR48: 25 PR48: 0 |
|
Нон-респондер |
NA |
T12/PR48: 27 Ll-T12/PR48: 25 PR48: 60 |
|
Побочные явления | ||
|
Прекращение терапии (%) |
8-12 |
NA |
|
SAE (%) |
10-14 |
11-15 |
|
Наиболее частые побочные явления |
Анемия, дисгевзия |
Сыпь, анемия, зуд, тошнота, диарея |
|
в группе тройной терапии |
|
|
NA – отсутствует; PR – пегинтерферон плюс рибавирин; RCT – рандомизированное контролированное исследование; SAE – серьезное нежелательное явление; SVR – стойкий вирусологический ответ.
*Группа с вводной терапией была включена в повторное исследование телапревира, но FDA утвердило схемы, не включающие вводную стратегию.
+Дизайн исследования BOC включал 4-недельную вводную фазу PeglFN и RBV и сравнивал тройную терапию, модифицируемую в зависимости от выраженности ответа, и тройную терапию фиксированной продолжительности (44 недели) с терапией пегинтерфероном и рибавирином. Пациенты, проходившие терапию BOC/RGT, модифицируемую в зависимости от выраженности ответа, и достигшие eRVR (не обнаруживаемая РНК HCV на 8-й неделе [4-й неделе тройной терапии]) получали ее дополнительные 24 недели (всего 32 недели терапии). Если eRVR не достигался, но РНК не обнаруживалась и на 12-й неделе, BOC отменялся на 32-й неделе и пациенты получали стандартное лечение еще 12 недель (всего 48 недель терапии). BOC/PR48: 4-недельная вводная терапия пегинтерфероном и рибавирином, после которой следовала тройная терапия в течение фиксированного периода 44 недели; PR48: PeglFN и RBV принимались в течение 48 недель.
++Телапревир (TVR) плюс пегинтерферон и рибавирин (PR) принимались с вводной 4-недельной стандартной терапией и без нее и сравнивались со стандартной терапией (SOC). T12PR48: TVR принимался 12 недель, после чего 36 недель принимались пегинтерферон и рибавирин; Ll-T12/PR48: пегинтерферон и рибавирин принимались 4 недели, затем 12 недель принимался TVR плюс пегинтерферон и рибавирин, а после этого 32 недели принимался пегинтерферон и рибавирин; PR48: пегинтерферон и рибавирин принимались в течение 48 недель.
Рис. 5. Показатели стойкого вирусологического ответа (SVR), общие и у пациентов с рецидивом и частичных респондеров, в терапии, применявшейся для пациентов с хронической инфекцией HCV генотипа 1, уже проходивших лечение ранее: Боцепревир (BOC) плюс пегинтерферон и рибавирин (PR) по сравнению со стандартной терапией (SOC). Все пациенты сначала проходили вводную терапию PegIFN и RBV в течение 4 недель, после которой следовала одна из следующих схем лечения: (1) Тройная терапия BOC/PR48 в течение 44 недель. (2) Тройная терапия BOCRGT в течение 32 недель, если был достигнут eRVR (РНК HCV не определялась на 8-й и 12-й неделе). Если eRVR не был достигнут, но РНК HCV не определялась на 12-й неделе, BOC отменялся на 32-й неделе и пациенты получали стандартную терапию еще 12 недель (всего 48 недель терапии). (3) Стандартная терапия, состоящая из PegIFN и RBV, принимавшихся в течение 48 недель.13
Значение вводной фазы терапии
В вопросе полезности вводной фазы существует некоторая неопределенность. Теоретически вводная фаза терапии PegIFN и RBV может улучшить эффективность лечения путем снижения уровней РНК HCV, что позволит стабилизировать уровни PegIFN и RBV при введении ингибиторов протеаз, тем самым, снижая риск возникновения вирусологического прорыва или резистентности. Кроме того, вводная стратегия позволяет определить реакцию на интерферон и произвести оценку SVR в процессе лечения у пациентов, принимающих ВОС или TVR. Пациенты, чей ответ на интерферон является субоптимальным, что определялось по снижению уровня РНК HCV менее чем на 1 log во время 4-недельного вводного периода, имеют более низкие показатели SVR, чем у пациентов с хорошим ответом на IFN во время вводного периода.12 Тем не менее, дополнительный прием ВОС пациентами со слабым ответом во время вводной фазы приводит к значительному улучшению показателей SVR (28% - 38% по сравнению с 4%, когда ингибитор протеазы не добавлялся), поэтому слабый ответ во время вводной фазы не должен служить причиной отказа пациентам в доступе к терапии ингибиторами протеазы.
Непосредственное сравнение групп с вводной терапией и без нее в исследовании ВОС фазы 2, однако, не продемонстрировало значительной разницы показателей SVR для 28-недельной (56 и 54%) или 48-недельной (75 и 67%) схемы с использованием вводной фазы или без нее, соответственно.11 Сравнение данных во всех группах лечения исследований фазы 2 показало тенденцию повышения процента вирусологического прорыва у пациентов, лечившихся ВОС без вводной фазы (9%) по сравнению с теми, кто получал вводную терапию (4%) (P = 0,06). Однако поскольку все данные фазы 3 основывались на схеме с вводной терапией, до тех пор, пока не было противоположной информации, ВОС должен использоваться с 4-недельной вводной фазой. Вводная стратегия не оценивалась в исследовании TVR фазы 3 у наивных пациентов, поэтому рекомендаций для этого препарата нет.
Рекомендации:
Для пациентов, получавших терапию ранее:
10. Повторное лечение боцепревиром или телапревиром вместе с пегинтерфероном альфа и рассчитанным по массе тела рибавирином можно рекомендовать для пациентов с рецидивом виремии или частичных респондеров после предыдущего курса лечения стандартным интерфероном альфа или пегинтерфероном альфа и/или рибавирином (класс 1, уровень А).
11. Повторное лечение телапревиром, вместе с пегинтерфероном альфа и рассчитанным по массе тела рибавирином, может использоваться для прежних нон-респондеров стандартной терапии интерфероном альфа или пегинтерфероном альфа и/или рассчитанным по массе рибавирином (класс 2b, уровень В).
12. Терапия, модифицированная в зависимости от выраженности ответа, пациентов, получавших терапию ранее, использующая схемы на основе боцепревира или телапревира, может рассматриваться для пациентов с рецидивом (класс 2a, уровень B для боцепревира; класс 2b, уровень С для телапревира), для частичных респондеров
(класс 2b, уровень B для боцепревира; класс 3, уровень C
для телапревира), но не может быть рекомендована для нон-респондеров (класс 3, уровень C).
13. Пациентам, проходящим повторную терапию боцепревиром плюс пегинтерфероном альфа и рибавирином, у которых продолжает обнаруживаться РНК HCV > 100 МЕ на 12-й неделе, должны быть отменены все виды терапии из-за высокой вероятности развития антивирусной резистентности (класс 1, уровень В).
14. Пациентам, проходящим повторную терапию телапревиром плюс пегинтерфероном альфа и рибавирином, у которых продолжает обнаруживаться РНК HCV > 1,000 МЕ на 4-й или 12-й неделе, должны быть отменены все виды терапии из-за высокой вероятности развития антивирусной резистентности (класс 1, уровень В).
Нежелательные явления
Нежелательные явления чаще возникали у пациентов, которые лечились ИНГИБИТОРами ПРОТЕАЗЫ, чем у тех, кто лечился только PegIFN и RBV. В исследованиях BOC наиболее частыми нежелательными явлениями были анемия и дисгевзия, тогда как в исследованиях TVR это были сыпь, анемия, зуд, тошнота и диарея, развивавшиеся чаще среди получавших терапиюTVR, чем у тех, кто получал стандартную терапию.12,16 В исследованиях TVR фазы 3 сыпь разной степени серьезности отмечалась у 56% пациентов, лечившихся по схеме на основе TVR, по сравнению с 32% пациентов, лечившихся по PegIFN и RBV.16 Сыпь была типичной экзематозной и макулопапулезной по характеру и соответствовала кожному высыпанию, вызванному лекарственными средствами. У большинства пациентов сыпь была от умеренной до средней степени серьезности, но в 4% случаев была серьезной (охватывавшей >50% поверхности тела). Развитие сыпи повлекло за собой отмену TVR в 6% случаев и отмену всей схемы в 1% случаев. Синдром Стивена Джонса или лекарственная кожная реакция с системными симптомами (DRESS) возникали у менее, чем 1% субъектов, но чаще, чем, как правило, наблюдалось для других препаратов. Ответ сыпи на локальное или системное лечение кортикостероидами и пероральными антигистаминными средствами был неопределенен. Зуд, обычно, но не всегда связанный с сыпью, отмечался примерно у 50% пациентов, получавших терапию TVR.16
Анемия развивалась у реципиентов обоих ИНГИБИТОРОВ ПРОТЕАЗЫ. Падение гемоглобина ниже 10 г/дл (2-я степень токсичности) наблюдалось у 49% пациентов, лечившихся по схемам с ВОС, по сравнению с 29% пациентов, лечившихся по стандартной схеме, несмотря на то, что у 9% пациентов гемоглобин опустился ниже 8,5 г/дл (3-я степень токсичности).12
У пациентов, лечившихся T12PR, уровни гемоглобина менее 10 г/дл наблюдались у 36% субъектов по сравнению с 14% пациентов, получавших SOC, а у 9% гемоглобин опустился ниже 8,5 г/дл.16 Поскольку гематопоэтические факторы роста в исследованиях TVR не разрешались, процент прекращения лечения был на 5-6% выше у пациентов с развившейся анемией, чем у пациентов без нее. Однако ни анемия, ни снижение дозы RBV не имели отрицательного влияния на показатель SVR. Следует сказать, что в исследованиях ВОС показатели SVR у пациентов, лечившихся только уменьшенной дозой RBV, были сравнимы с показателями у пациентов, проходивших терапию эритропоэтином.23 Точно так же, в исследованиях TVR, уменьшение дозы RBV не влияло на показатели SVR, поэтому снижение дозы должно быть первичной реакцией на лечение анемии.24 Поскольку длительность терапии BOC (24 - 44 недели) больше длительности терапии TVR (12 недель), частота возникновения анемии, вероятно, будет больше в схемах, содержащих ВОС, вызывая большее снижение дозы RBV и применение эритропоэтина. Однако потенциальная польза эритропоэтина должна оцениваться с учетом его потенциальных побочных эффектов, того факта, что FDA не одобрило его использование в терапии HCV, и его значительную стоимость. Если возникает побочный эффект, ограничивающий лечение ингибиторами протеаз, терапию PegIFN и RBV можно продолжить, при наличии ответа во время лечения. Данных, позволяющих рекомендовать замену одного ингибитора протеазы для HCV на другой, не существует. Если у пациента возникает серьезная побочная реакция на PegIFN и/или RBV, необходимо уменьшить дозу PegIFN и/или RBV либо отменить прием препаратов. Если прием
PegIFN и/или RBV отменяется, прекращается и прием ингибиторов протеаз HCV. Дополнительную информацию о других побочных эффектах можно найти на листке-вкладыше.
Лекарственные взаимодействия
В связи с тем, что пациенты с хроническим гепатитом С часто принимают дополнительные препараты, кроме тех, которые воздействуют на вирус, и поскольку ингибиторы протеаз могут ингибировать ферменты, метаболизирующие препарат, такие как цитохром P450 2C (CYP2C), CYP3A4 или CYP1A, оба препарата, BOC и TVR исследовались на потенциальное взаимодействие с рядом лекарственных средств, которые могут вводиться вместе с ними. Сюда входили статины, иммунодепрессанты, препараты, используемые для лечения коинфекции ВИЧ, оппортунистических инфекций, расстройств настроения, а также препараты для лечения наркозависимости.
Как для ВОС, так и для TVR, отмечались взаимодействия с несколькими исследуемыми препаратами, вызывающие как повышение, так и снижение фармакокинетических параметров. Поэтому очень важно, чтобы медицинское учреждение или врач, прежде чем начинать лечение хронического гепатита С, изучили информацию, приведенную в листке-вкладыше, для каждого препарата.
Вирусная резистентность и мониторинг
Появление вариантов антивирусной резистентности во время проведения терапии на основе ингибиторов протеаз наблюдалось во всех исследованиях и связывалось с вирусологической неэффективностью и рецидивом (Таблицы 2 и 3). Мутации, дающие высокий или низкий уровень резистентности к BOC и TVR, концентрируются вокруг каталитического центра сериновой протеазы NS3/4A. Подобные варианты обнаруживались у субъектов, лечившихся BOC и TVR, наводя на мысль о существовании некоторой перекрестной резистентности между двумя ингибиторами протеаз. В обоих исследованиях фазы 3 проводилось секвенирование региона NS3/4A у всех субъектов на исходном уровне и у всех субъектов, не достигших SVR. Варианты антивирусной резистентности обнаруживались у небольшого количества пациентов на исходном уровне, у 7% в исследовании BOC и у 5% в исследовании TVR, что не влияло на ответ на оба ингибитора протеаз.25,26 Таким образом, в настоящее время нет клинических показаний для проведения контроля резистентности на исходном уровне.
Среди наивных пациентов, получавших терапию по схеме ВОС, варианты антивирусной резистентности, развившейся во время лечения, наблюдались у 16% пациентов (Таблица 2).12 В ходе лечения антивирусные варианты, связанные с TVR, появлялись у12% наивных пациентов и у 22% пациентов, лечившихся ранее (Таблицы 2 и 3).16,17 У большинства (80%-90%) пациентов, имевших вирусологический прорыв или неполную супрессию виремии во время лечения, или рецидив виремии после прекращения терапии ингибиторами протеазы, были обнаружены варианты антивирусной резистентности. В исследованиях BOC слабый ответ на интерферон (снижение РНК HCV <1 log во время вводной фазы) был связан с высоким уровнем развития резистентности.12 Среди пациентов, лечившихся TVR, секвенирование геномов в популяции позволило сделать вывод, что высокая резистентность чаще развивается при появлении вирусологической неэффективности в первые 12 недель лечения, а варианты низкой резистентности более часты при появлении вирусологической неэффективности позже, во время лечения только
PegIFN и RBV. Данные наблюдения подчеркивают важность ответа на интерферон для предотвращения появления антивирусной резистентности.
Клиническая значимость вариантов антивирусной резистентности, появляющихся во время терапии ингибиторами протеазы, неясна. В ходе долгосрочных наблюдений пациентов в исследованиях фазы 2 варианты резистентности к ВОС были обнаружены у 43% субъектов через два года. Точно так же среди пациентов с документированными вариантами резистентности к TVR в исследованиях TVR фазы 3 у 40% все еще обнаруживались варианты резистентности по прошествии среднего периода наблюдений 45 недель.27 В общем, уменьшение или потеря вариантов, возможно, были связаны с уровнем физической формы.
Для определения влияния выбора этих вариантов во время и после терапии ингибиторами протеазы на последующий выбор терапии необходимы дополнительные данные. В исследованиях фазы 3 появление вариантов резистентности и вирусологического прорыва было более частым у пациентов с HCV подтипа 1а, чем у пациентов с подтипом 1b, в результате чего, для выбора вариантов резистентности HCV подтипа 1b необходим более высокий генетический барьер, чем для подтипа 1а. 28 Таким образом, разделение HCV по подтипам может иметь важную роль в выборе будущих схем лечения и прогнозировании развития резистентности. И, наконец, минимизация развития компенсаторных мутаций может вызвать более раннее прекращение терапии ингибиторами протеазы, если успех антивирусной терапии маловероятен. Хотя правила прекращения лечения в исследованиях фазы 2 и 3 менялись в широких пределах, 4-я и 12-я недели тройной терапии остаются ключевыми для принятия решения о прекращении терапии на основании уровней РНК HCV. Текущие данные свидетельствуют, что для пациентов, получавших ВОС, терапия должна быть прекращена на 12-й неделе, если уровень РНК >100 МЕ/мл или >10 -15 МЕ/мл на 24-й неделе лечения; для TVR терапия должна быть прекращена на 4-й или 12-й неделе, если уровень РНК >1,000 МЕ/мл или РНК HCV обнаруживается на 24-й неделе.
Рекомендации:
15. Пациентам, у которых развивается анемия на фоне терапии хронического гепатита С ингибиторами протеазы, должна быть уменьшена доза рибавирина (класс 2а, уровень А).
16. Пациентам, проходящим лечение ингибиторами протеазы, должен проводиться тщательный мониторинг уровней РНК HCV; прием ингибиторов протеазы прекращается, если наблюдается вирусологический прорыв (повышение РНК HCV в сыворотке >1 log относительно низшего предела) (класс 1, уровень A).
17. Пациенты, не имеющие вирусологического ответа, пациенты, имеющие вирусологический прорыв или рецидив при лечении одним из ингибиторов протеазы, не должны проходить повторное лечение другим ингибитором протеазы (класс 2а, уровень С).
Роль анализа IL28B в принятии решения о лечении и выборе схемы лечения
Вероятность достижения SVR при лечении PegIFN и RBV и спонтанного разрешения инфекции HCV отличается в зависимости от нуклеотидной последовательности вблизи гена IL28B или лямбда-интерферона 3-го типа в хромосоме 19.18,19 Одиночным нуклеотидным полиморфизмом, позволяющим делать прогнозы с высокой степенью уверенности, является обнаружение С или Т аллеля в позиции rs12979860.18 Генотип CC в 2 раза чаще находят у лиц с самопроизвольным разрешением инфекции HCV, чем у лиц с хроническим гепатитом С. Среди лиц с хронической инфекцией гепатита С генотипа 1, которые лечились PegIFN и RBV, SVR достигался у 69%, 33% и 27% белых пациентов, имевших генотипы CC, CT и TT, соответственно; среди черных пациентов показатели SVR составляли 48%, 15% и 13% для генотипов CC, CT и TT генотипов, соответственно.29
Прогностическая значимость анализа генотипа IL28B для SVR превосходит значимость уровня РНК HCV после предварительного лечения, стадии фиброза, возраста и пола; она выше для вируса HCV генотипа 1, чем для вирусов генотипов 2 и 3.29,30 Существуют и другие полиморфизмы вблизи гена IL28B, которые также прогнозируют SVR, включая обнаружение G или Т аллеля в позиции
rs8099917, где Т является благоприятным генотипом, и, по существу, дают такую же информацию у белых пациентов, что и генотип С в позиции rs12979860.31,32
В одном исследовании, так же, как и в предварительных анализах регистрационных данных фазы 3, генотип IL28B сохранял прогностическую значимость для SVR даже у лиц, принимавших
BOC или TVR.33 У белых пациентов, рандомизированных в исследованиях SPRINT 2 для приема BOC в течение 48 недель, SVR
достигал 80%, 71% и 59% пациентов с генотипами CC, CT и TT, соответственно.34 У белых пациентов в исследовании ADVANCE, рандомизированных для приема TVR в течение 12 недель, SVR достигал 90%, 71% и 73% пациентов с генотипами CC, CT и TT, соответственно.35 Генотип IL28B прогнозирует также вероятность квалификации для RGT. У белых наивных пациентов, рандомизированных в исследовании SPRINT 2 для приема BOC, порог РНК HCV на 8-й неделе был достигнут у 89% и 52% пациентов с генотипами CC и CT/TT, соответственно.34 У белых наивных пациентов, рандомизированных для приема TVR в исследовании ADVANCE, eRVR был достигнут у 78%, 57% и 45% пациентов с генотипами CC, CT и TT, соответственно.35
Хотя генотип IL28B и дает информацию о вероятности SVR и возможности сокращения терапии, что может быть важно для врача и пациента, нет достаточных данных для прекращения лечения ингибиторами протеазы у пациентов с благоприятным генотипом СС из-за наличия потенциала сокращения терапии и тенденции повышения показателей SVR, наблюдаемой в исследовании TVR. Кроме того, отрицательное прогностическое значение Т аллеля при терапии, включающей ингибиторы протеазы, недостаточно для ограничения терапии всех пациентов, поскольку SVR был достигнут больше чем у половины белых пациентов с генотипом ТТ.34,35
Таким образом, эти данные показывают, что генотип IL28B является важным прогностическим фактором наличия ответа на терапию. Возможность проведения анализа рассматривается с целью оказания влияния на решение врача или пациента об инициировании терапии. Достаточной информации для определения возможности использования анализа IL28B для рекомендации выбора SOC или схемы на основе ингибиторов протеазы при благоприятном генотипе (СС), а также для принятия решения по длительности терапии по той или другой схеме, не имеется.
Рекомендации:
18. Генотип IL28B является надежным фактором прогнозирования SVR для пегинтерферона альфа и рибавирина, а также для тройной терапии ингибитором протеазы у пациентов с хронической инфекцией вирусом гепатита С генотипа 1. Анализ может проводиться в том случае, если пациенту или врачу необходимо получить дополнительную информацию о вероятности ответа на терапию или о возможной продолжительности лечения (класс 2а, уровень В).
Специальные популяции
Существует очень мало информации по многим подгруппам с огромной неудовлетворенной потребностью в лечении (например, пациенты, коинфицированные ВИЧ и HCV, пациенты с некомпенсированным циррозом и пациенты после трансплантации печени). Данные исследований фазы 1 и 2 предоставили промежуточную информацию, которая может использоваться в решении проблем лечения. BOC и TVR подвергаются экстенсивному метаболизму в печени, ВОС с помощью альдокеторедуктазы (АКР), но также с помощью системы ферментов цитохрома P450, выводится, в основном, с калом, выведение с мочой минимально. Таким образом, корректировка дозы ВОС или TVR у пациентов с почечной недостаточностью не требуется. Не наблюдалось клинически значимых различий фармакокинетических параметров у пациентов с хронической печеночной недостаточностью разной степени, лечившихся ВОС, поэтому у пациентов с циррозом и печеночной недостаточностью корректировка дозы данного препарата не требуется. Хотя TVR и может использоваться для лечения пациентов с умеренной печеночной недостаточностью (класс А, индекс 5 или 6 по шкале Чайлда-Туркотта-Пью), его не следует использовать у пациентов, инфицированных HCV, со средней и тяжелой печеночной недостаточностью, поскольку данные по фармакокинетике и безопасности использования препарата у этих пациентов отсутствуют. Как отмечалось выше, ВОС и TVR являются ингибиторами CYP3A4, и параллельный прием препаратов, известных как субстраты CYP3A4, должен назначаться с осторожностью, при условии строгого клинического мониторинга. Фармакокинетические взаимодействия имеют особые последствия у ВИЧ-инфицированных пациентов и пациентов с трансплантированными органами; межлекарственные взаимодействия усложняют стандартные методы лечения, поэтому BOC или TVR в популяции пациентов с коинфекцией ВИЧ или трансплантированными органами должны назначаться с осторожностью, при условии строгого клинического мониторинга. TVR и BOC не рекомендуются для детей и подростков младше 18 лет, поскольку данные по эффективности и безопасности препаратов в этой популяции отсутствуют. Таким образом, несмотря на то, что BOC и TVR являются многообещающими препаратами для улучшения SVR в специальных популяциях пациентов, множество сложных проблем в лечении еще должны быть изучены в дополнительных исследованиях фаз 2 и 3.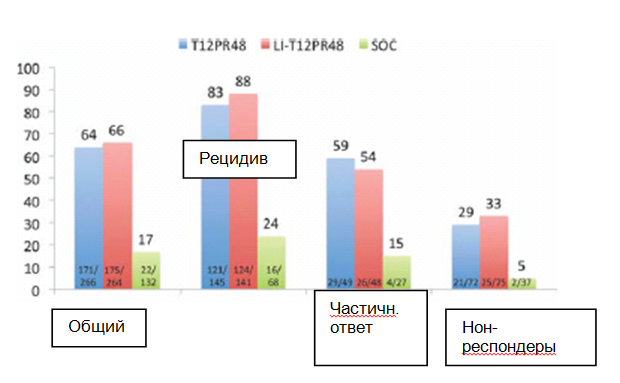
Рис. 6. Показатели стойкого вирусологического ответа (SVR), общего и среди пациентов с рецидивом, частичных и нон-респондеров, у пациентов с хронической инфекцией гепатита С генотипа 1, уже лечившихся ранее. T12PR48: Телапревир (TVR) плюс пегинтерферон и рибавирин (PR), принимавшиеся в течение 12 недель, после чего следовала терапия 36PR в течение 12 недель и терапия PR в течение 32 недель; SOC состояла из PegIFN и RBV, принимавшихся в течение 48 недель.17
References
1. Eddy D. A manual for assessing health practices and designing practice guidelines. Philadelphia: American College of Physicians. 1996.
2. American Gastroenterological Association policy statement on the use of medical practice guidelines by managed care organizations and insurance carriers. Gastroenterology 1995;108:925-926.
3. American Heart Association. Accessed August 2011.
4. Shiffman RN, Shekelle P, Overhage JM, Slutsky J, Grimshaw J, Deshpande AM. Standardized reporting of clinical practice guidelines: a proposal from the Conference on Guideline Standardization. Ann Intern Med 2003;139:493-498.
5. Manns MP, McHutchison JG, Gordon SC, Rustgi VK, Shiffman M, Reindollar R, et al. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial. Lancet 2001;358:958-965.
6. Fried MW, Shiffman ML, Reddy KR, Smith C, Marinos G, Gonc.ales FL Jr, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002;347:975-982.
7. Hadziyannis SJ, Sette H Jr, Morgan TR, Balan V, Diago M, Marcellin P, et al.; for PEGASYS International Study Group. Peginterferonalpha2a and ribavirin combination therapy in chronic hepatitis C: a randomized study of treatment duration and ribavirin dose. Ann Intern Med 2004;140:346-355.
8. Veldt BJ, Heathcote EJ, Wedemeyer H, Reichen J, Hofmann WP, Zeuzem S, et al. Sustained virologic response and clinical outcomes in patients with chronic hepatitis C and advanced fibrosis. Ann Intern Med 2007;147:677-684.
9. Bruno S, Crosignani A, Facciotto C, Rossi S, Roffi L, Redaelli A, et al. Sustained virologic response prevents the development of esophageal varices in HEPATOLOGY, Vol. 54, No. 4, 2011 GHANY ET AL. 1443 compensated, Child-Pugh class A hepatitis C virus-induced cirrhosis. A 12- year prospective follow-up study. HEPATOLOGY 2010;51:2069-2076.
10. Morgan TR, Ghany MG, Kim HY, Snow KK, Shiffman ML, De Santo JL, Lee WM, Di Bisceglie AM, Bonkovsky HL, Dienstag JL, Morishima C, Lindsay KL, Lok AS. Outcome of sustained virological responders with histologically advanced chronic hepatitis C. HEPATOLOGY 2010;52:833-844.
11. Kwo PY, Lawitz EJ, McCone J, Schiff ER, Vierling JM, Pound D, et al.; for SPRINT-,1 Investigators. Efficacy of boceprevir, an NS3 protease inhibitor, in combination with peginterferon alfa-2b and ribavirin in treatment-naive patients with genotype 1 hepatitis C infection (SPRINT-1): an open-label, randomised, multicentre phase 2 trial. Lancet 2010;376:705-716.
12. Poordad F, McCone JJr, Bacon BR, Bruno S, Manns MP, Sulkowski MS, et al.; for SPRINT-,2 Investigators. Boceprevir for untreated chronic HCV genotype 1 infection. N Engl J Med 2011;364: 1195-1206.
13. Bacon BR, Gordon SC, Lawitz E, Marcellin P, Vierling JM, Zeuzem S, et al.; for HCV RESPOND-,2 Investigators. Boceprevir for previously treated chronic HCV genotype 1 infection. N Engl J Med 2011;364: 1207-1217.
14. McHutchison JG, Everson GT, Gordon SC, Jacobson IM, Sulkowski M, Kauffman R, et al.; for PROVE,1 Study Team. Telaprevir with peginterferon and ribavirin for chronic HCV genotype 1 infection. N Engl J Med 2009;360:1827-1838.
15. He.zode C, Forestier N, Dusheiko G, Ferenci P, Pol S, Goeser T, et al.; for PROVE, 2 Study Team. Telaprevir and peginterferon with or without ribavirin for chronic HCV infection. N Engl J Med 2009;360: 1839-1850.
16. Jacobson IM, McHutchison JG, Dusheiko G, Di Bisceglie AM, Reddy KR, Bzowej NH, et al.; for ADVANCE Study Team. Telaprevir for previously untreated chronic hepatitis C virus infection. N Engl J Med 2011;364:2405-2416.
17. Zeuzem S, Andreone P, Pol S, Lawitz E, Diago M, Roberts S, et al. Telaprevir for retreatment of HCV infection. N Engl J Med 2011;364: 2417-2428. 18. Ge D, Fellay J, Thompson AJ, Simon JS, Shianna KV, Urban TJ, et al. Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance. Nature 2009;461:399-401.
19. Thomas DL, Thio CL, Martin MP, Qi Y, Ge D, O’Huigin C, et al. Genetic variation in IL28B and spontaneous clearance of hepatitis C virus. Nature 2009;461:798-801.
20. Foster GR, He.zode C, Bronowicki JP, Carosi G, Weiland O, Verlinden L, et al. Activity of telaprevir alone or in combination with peginterferon alfa-2a and ribavirin in treatment na?.ve genotype 2 and 3 hepatitis C patients: interim results of study C209. J Hepatol 2009;50(suppl 1):S22.
21. Silva M, Kasserra C, Gupta S, Treitel M, Hughes E, O’Mara E, et al. Antiviral activity of boceprevir monotherapy in treatment-naive subjects with chronic hepatitis C genotype 2/3. Hepatol Int 2011;5:3–558.
22. Sherman KE, Flamm SL, Afdhal NH, Nelson DR, Sulkowski MS, Everson GT, et al. Telaprevir in combination with peginterferon alfa 2a and ribavirin for 24 or 48 weeks in treatment-naive genotype 1 HCV patients who achived an extended rapid virological response: final results of Phase 3 ILLUMINATE study [Abstract LB-2]. HEPATOLOGY 2010;52:401A.
23. Sulkowski MS, Poordad F, Manns MS, Bronowicki JP, Reddy KR, Harrison SA, et al. Anemia during treatment with peginterferon alfa-2b/ ribavirin with or without boceprevir is associated with higher SVR rates: analysis of previously untreated and previous-treatment-failure patients. J Hepatol 2011;54(suppl 1):S195-S196.
24. Sulkowski MS, Reddy R, Afdhal NH, Di Bisceglie AM, Zeuzem S, Poordad F, et al. Anemia had no effect on efficacy outcomes in treatment- naive patients who received telaprevir-based regimen in the ADVANCE and ILLUMINATE phase 3 studies. J Hepatol 2011; 54(suppl 1):S195.
25. Vierling JM, Kwo PY, Lawitz E, McCone J, Schiff ER, Pound D, et al. Frequencies of resistance-associated amino acid variants following combination treatment with boceprevir plus PEGINTRON (Peginterferon Alfa-2b)/ribavirin in patients with chronic hepatitis C, genotype 1 (G1) [Abstract]. HEPATOLOGY 2010;52:702A.
26. Highlights of Prescribing Information for Incivek. www.accessdata.fda.-gov/drugsatfda_docs/label/2011/201917lbl.pdf. Accessed August 2011.Vertex Pharmaceuticals, Cambridge, MA.
27. Zeuzem S, Sulkowski M, Zoulim F, Sherman KE, Albert A, Wei LJ, et al. Long-term follow-up of patients with chronic hepatitis C treated with telaprevir in combination with peginterferon alfa-2a and ribavirin: interim analysis of the Extend study [Abstract]. HEPATOLOGY 2010;52: 436A.
28. Sarrazin C, Kieffer TL, Bartels D, Hanzelka B, Muh U, Welker M, et al. Dynamic hepatitis C virus genotypic and phenotypic changes in patients treated with the protease inhibitor telaprevir. Gastroenterology 2007;132:1767-1777.
29. Thompson AJ, Muir AJ, Sulkowski MS, Ge D, Fellay J, Shianna KV, et al. Interleukin-28B polymorphism improves viral kinetics and is the strongest pretreatment predictor of sustained virologic response in genotype 1 hepatitis C virus. Gastroenterology 2010;139:120-129.
30. Mangia A, Thompson AJ, Santoro R, Piazzolla V, Tillmann HL, Patel K, et al. An IL28B polymorphism determines treatment response of hepatitis C virus genotype 2 or 3 patients who do not achieve a rapid virologic response. Gastroenterology 2010;139:821-827.
31. Suppiah V, Moldovan M, Ahlenstiel G, Berg T, Weltman M, Abate ML, et al. IL28B is associated with response to chronic hepatitis C interferon-alpha and ribavirin therapy. Nat Genet 2009;41:1100-1104.
32. Tanaka Y, Nishida N, Sugiyama M, Kurosaki M, Matsuura K, Sakamoto N, et al. Genome-wide association of IL28B with response to pegylated interferon-alpha and ribavirin therapy for chronic hepatitis C. Nat Genet 2009;41:1105-1109.
33. Akuta N, Suzuki F, Hirakawa M, Kawamura Y, Yatsuji H, Sezaki H, et al. Amino acid substitution in hepatitis C virus core region and genetic variation near the interleukin 28B gene predict viral response to telaprevir with peginterferon and ribavirin. HEPATOLOGY 2010;52: 421-429.
34. Poordad F, Bronowicki JP, Gordon SC, Zeuzem S, Jacobson IM, Sulkowski M, et al. IL28B polymorphism predicts virological response in patients with chronic hepatitis C genotype 1 treated with Boceprevir (BOC) combination therapy. J Hepatol 2011;54(suppl 1):S6.
35. Jacobson IM, Catlett I, Marcellin P, Bzowej NH, Muir AT, Adda N, et al. Telaprevir substantially improves SVR rates across all IL28b genotypes in the advanced trial. J Hepatol 2011;54:S1369.


